Blood:肿瘤特异性T细胞不能根除淋巴瘤的起始B细胞!
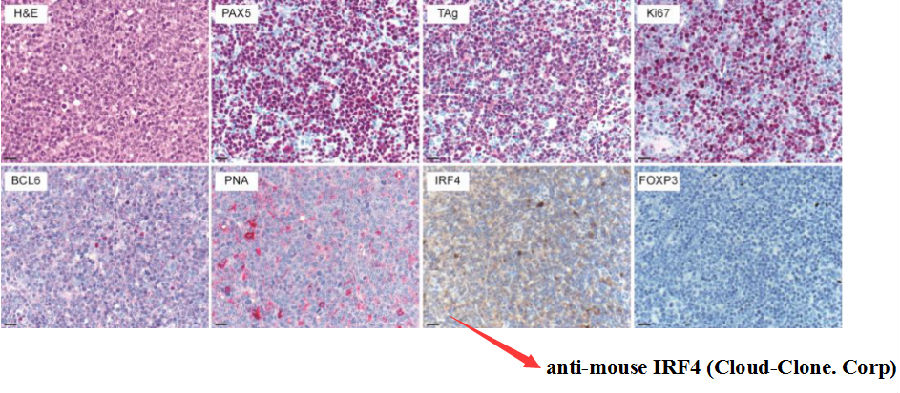
云克隆抗体anti-mouse IRF4在Blood发表!
文章题目: 肿瘤特异性T细胞不能根除淋巴瘤的起始B细胞!
要点: 1. 在新构建的小鼠模型中,肿瘤特异性T细胞缺失会增加B细胞淋巴瘤的发生率;
2. 淋巴瘤的起始B细胞不能被免疫系统清除,使得依然有进展成淋巴瘤的风险。
那么,让我们一起来看一下作者是怎么进行论证的!
第一步,建立B细胞淋巴瘤。
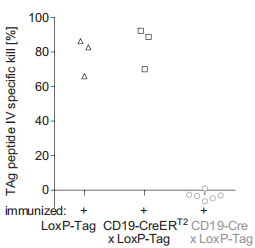
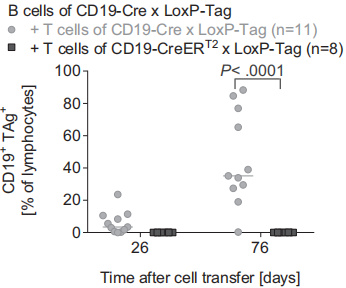
将未成年的携带TAg的LoxP-Tag小鼠分别和CD19-Cre或CD19-CreERT2小鼠杂交,通过Cre/loxP介导的重组酶,TAg在B细胞系中特异性表达的开关被开启。在CD19-Cre x LoxP-Tag小鼠中,Cre重组酶的活性是持续性表达的,而CD19-CreERT2 x LoxP-Tag小鼠中的Cre重组酶的活性依赖于外源性的他莫昔芬。借助RFP荧光小鼠,分析了两种Cre重组酶的重组率,结果显示CD19-Cre较高。但以上验证仅是一种推断,因为TAg和RFP转基因插入的是不同的基因位点。为了评估CD19-Cre x LoxP-Tag和CD19-CreERT2 x LoxP-Tag小鼠产生的TAg对特异性CD8+ T细胞应答的能力,进行了四聚体技术分析和细胞胞毒实验,结果表明CD19-Cre x LoxP-Tag小鼠的CD8+ T细胞TAg耐受,如图所示:
第二步,验证CD19-Cre x LoxP-Tag而不是CD19-CreERT2 x LoxP-Tag小鼠易发展成B细胞淋巴瘤。
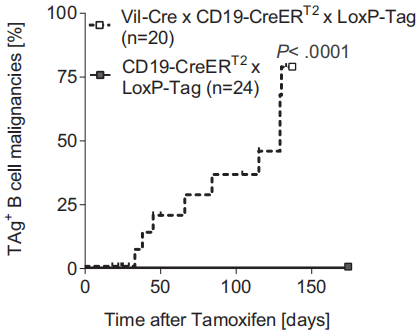
根据第一步的结果我们很容易推断,CD19-Cre x LoxP-Tag小鼠易发展成B细胞淋巴瘤,而不是CD19-CreERT2 x LoxP-Tag小鼠。那么,作者从哪些方面进行了验证呢?
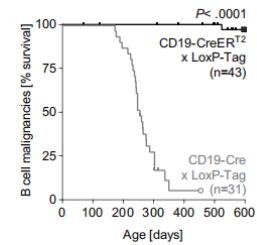
通过比较CD19-Cre x LoxP-Tag和他莫昔芬诱导的CD19-CreERT2 x LoxP-Tag小鼠在B细胞淋巴瘤生存率和脾、淋巴结组织化学染色以及流式细胞分析脾细胞B细胞谱系标志物和TAg表达情况。
结果显示CD19-Cre x LoxP-Tag而不是CD19-CreERT2 x LoxP-Tag小鼠易发展成B细胞淋巴瘤并且生存率更低。其B细胞淋巴瘤生存率统计结果如图:
B细胞淋巴瘤生发中心标志物检测阴性——该B细胞淋巴瘤为生发中心外B细胞起源
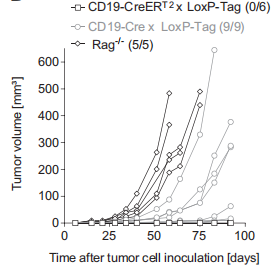
第三步,验证体外注射TAg+ B细胞是否具有致瘤性和免疫原性。
分别将携带淋巴瘤的CD19-Cre x LoxP-Tag小鼠和无肿瘤LoxP-Tag对照同窝小鼠的1 x 106个脾细胞静脉内注射到Rag- / - 小鼠体内。从生存曲线和脾脏大小进行评估的结果如下图:

以上结果说明,体外注射 TAg+ B细胞具有致瘤性和免疫原性。
第四步,验证在TAg特异性T细胞缺失的情况下,淋巴瘤的发病率增加。
分别将CD19-CreERT2 x LoxP-Tag和CD19-Cre x LoxP-Tag小鼠的B细胞或脾细胞静脉注射到Rag- / - 小鼠。比较CD19+ TAg+淋巴细胞百分比、生存率、B细胞淋巴瘤TAg+百分比,可得到结论:在TAg特异性T细胞缺失的情况下,淋巴瘤的发病率增加。
接下来分析内源性TAg特异性CD8+ T细胞的应答反应。
为了排除内源性TAg特异性CD8+ T细胞对实验的影响,比较LoxP-Tag和CD19-CreERT2 x LoxP-Tag小鼠的T细胞应答情况并无显著性差异,进一步通过细胞胞毒实验证实TAg特异性的CTL应答。
最后确定,TAg特异性T细胞不能根除淋巴瘤起始B细胞。
在淋巴瘤发展过程中,可以发现经过他莫昔芬诱导的CD19-CreERT2 x LoxP-Tag所有的小鼠的血细胞中均能检测到TAg mRNA。
在致癌基因诱导前一周,用TAg+的癌细胞免疫小鼠,结果表明尽管诱导了免疫应答,但仍未能清除TAg起始B细胞,如下图所示:
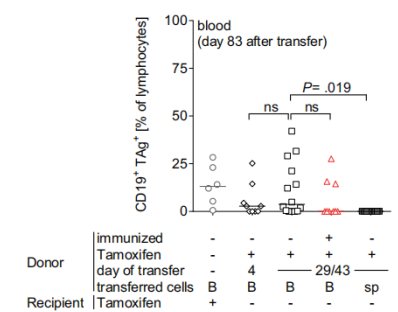
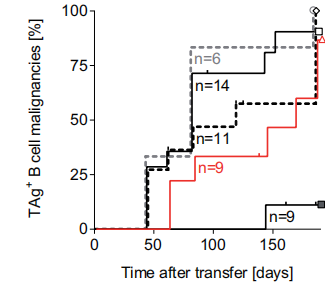
该结论也进一步在脾、骨髓和腹膜腔中得到了证实。
迄今为止,对B细胞淋巴瘤与T细胞之间的相互作用知之甚少。研究者通过建立转基因小鼠模型,诱导B细胞特异性的癌基因——SV40 T抗原(TAg)表达,研究肿瘤特异性T细胞在自发性B细胞淋巴瘤发展中的作用。
让我们来为云克隆抗体anti-mouse IRF4(货号:PAB755Mu01)打call!也预祝云克隆抗体产品今后可以更多的为科学研究作贡献。