金纳米粒子(AuNPP-FA)调控肿瘤血管系统正常化

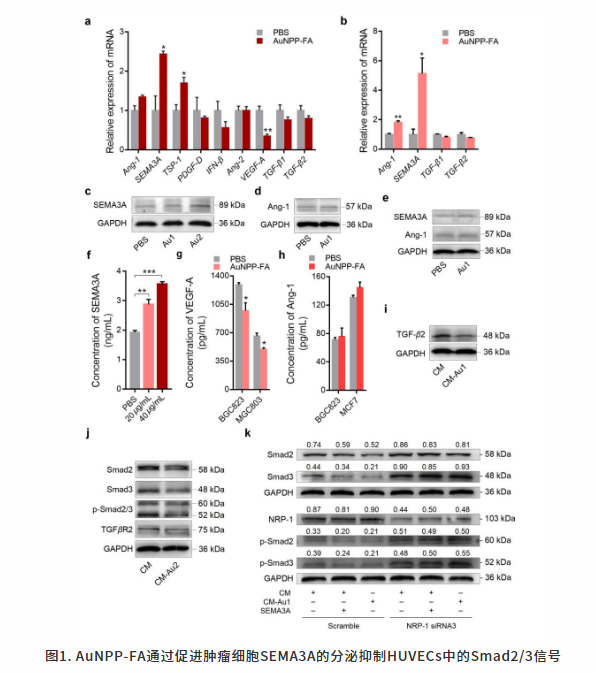
2020年5月15日,来自南方医科大学南方医院肿瘤科的Wangjun Liao教授和加拿大曼尼托巴大学农业学院的Malcolm Xing教授共同发表题为“Gold Nanoparticles Induce Tumor Vessel Normalization and Impair Metastasis by Inhibiting Endothelial Smad2/3 Signaling”的文章。研究发现一种改进的靶向聚合物和叶酸修饰的金纳米粒子(AuNPP-FA)在体内外均能抑制肿瘤增殖,并在体内控制肿瘤转移。同时发现,AuNPP-FA除了能够抑制肿瘤血管生成外,还通过增加周细胞覆盖率、上调内皮细胞的血管内皮钙粘蛋白(VE-cadherin, VE-cad)水平来加强紧密连接,使肿瘤血管系统正常化。
在这篇文章中,云克隆ELISA试剂盒(血管内皮生长因子A(VEGFA)ELISA Kits,SEA143Hu;信号素3A(SEMA3A)ELISA Kits,SEL917Hu)再次受到了科研工作者们的认可。

血管内皮生长因子A ELISA Kit 信号素3A ELISA Kit
货号:SEA143Hu 货号:SEL917Hu
实验方法:双抗夹心 实验方法:双抗夹心
检测范围:15.6-1,000pg/mL 检测范围:1.56-100ng/mL
研究介绍
肿瘤血管结构和功能异常导致的血管灌注不足是阻碍化疗药物输送的重要因素。它可能导致局部药物浓度不足,抗肿瘤疗效差等情况。此外,受损的内皮连接和肿瘤血管周细胞覆盖率不足可能促进肿瘤细胞灌注和远端器官转移。因此,使肿瘤血管的正常化来增加血管灌注,恢复内皮连接可能是一种更有效控制肿瘤的方法。纳米技术在早期诊断、预防、生物成像、治疗和药物传输方面具有效用。AuNPs具有良好的生物相容性、低毒性和易于表面功能化,是一种合适的药物载体。研究人员开发出一种通过共价键或非共价键将AuNPs与靶向物结合的癌症治疗方法。AuNPP-FA在体内外均能抑制肿瘤增殖,并在体内控制肿瘤转移。同时发现,AuNPP-FA除了能够抑制肿瘤血管生成外,还通过增加周细胞覆盖率、上调内皮细胞的VE-cad水平来加强紧密连接,使肿瘤血管系统正常化。这降低了血管通透性,改善了血管灌注,缓解了组织缺氧。由于CD3+CD8+ T淋巴细胞浸润增加,免疫治疗反应增强。AuNPP-FA增加癌细胞中SEMA3A的表达和分泌,进一步抑制人脐静脉内皮细胞中Smad2/3信号通路,这使肿瘤血管正常化并抑制转移。因此,AuNPP-FA在临床应用上有很大的潜力。