炎症小体——炎症反应的重要成员!
炎症小体的概念在2002年首次被提出,它是多种蛋白质组成的复合体,在骨髓细胞中产生,是天然免疫系统的重要组成部分。在感知外界病原体或损伤后,传递信号给免疫系统,启动炎症。目前已发现的炎症小体有多种,包括NLRP1炎症小体、NLRP3炎症小体、NLRC4炎症小体和AIM2炎症小体等。已知发现的炎症小体一般含有凋亡相关微粒蛋白(ASC)、Caspase蛋白酶以及NOD样受体家族蛋白(如NLRP3)或HIN200家族蛋白(如AIM2)。
炎症小体通过引起Caspase-1的剪切和活化,进而在天然免疫防御的过程中促进pro-IL1β和pro-IL18的成熟和分泌,产生IL1β和IL18。还能调节Caspase-1依赖的细胞焦亡,诱导细胞在炎性和应激的条件下死亡。因为活化的Caspase-1能剪切Gasdermin D,使其插入到膜中,形成孔隙并诱导细胞焦亡。已经确定多种炎症小体参与了针对多种病原体的宿主防御反应,病原体也有多种相应的机制来抑制炎症小体的活化。
目前研究较多的是NLRP3炎症小体。NLRP3炎症小体由ASC、Caspase-1和NLRP3组成。ASC作为接头蛋白包含PYD和CARD结构域,NLRP3作为受体蛋白含有包括PYD在内的三个结构域,Caspase-1作为效应蛋白在未激活状态下含有Caspase和CARD结构域。ASC的PYD结构域能跟NLRP3的PYD结构域相互作用,ASC的CARD结构域能跟Caspase-1的CARD结构域相互作用,所以ASC在这里类似桥梁,连接受体蛋白NLRP3和效应蛋白Caspase-1。NLRP3炎症小体蛋白质结构可表示为:LRR-NACHT-PYD : PYD-CARD : CARD-Caspase。NLRP3炎症小体的组成及功能见示意图1。

图1. NLRP3炎症小体的组成及功能(图片来源于《Journal of Neuroinflammation》杂志)
在受到激动剂(如活性氧压力、细菌mRNA、微生物毒素、跟阿尔茨海默病相关的β-淀粉样蛋白、动脉粥样硬化相关的胆固醇结晶、代谢产物饱和脂肪酸等)刺激时,NLRP3的LRR结构域可以识别到这些危险信号,细胞通过上述相互作用激活Caspase-1。
研究表明与野生型小鼠相比,NLRP3和Caspase-1缺陷的小鼠在流感病毒感染时IL-1β和IL-18的分泌显著降低,呼吸道炎症明显削弱且死亡率显著提高。NLRP3缺陷小鼠肺泡内有大量胶原沉淀物, 上皮细胞严重坏死,并表现出呼吸衰竭,提示NLRP3炎症小体在感染后的组织修复中发挥作用。此外,NLRP3炎症小体的活化在诱导适应性抗病毒免疫中也发挥重要作用。由于能被多种类型的病原体或危险信号激活,NLRP3炎症小体在多种疾病过程中都发挥了关键作用,包括家族性周期性自身炎症反应、2型糖尿病、阿尔兹海默症、哮喘及过敏性气道炎症、心肌梗死和动脉粥样硬化症等。由此可见,炎症小体可能可以为各种炎症性疾病的治疗提供新的靶点。
小编搜索了一下,2021年以来仅仅NLRP3炎症小体有关的研究就有几千篇,炎症小体的研究热度可见一斑,以下列举了其中的5篇供读者参考。
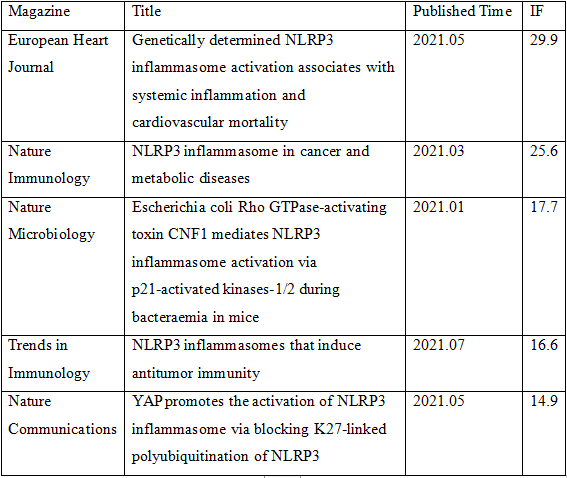
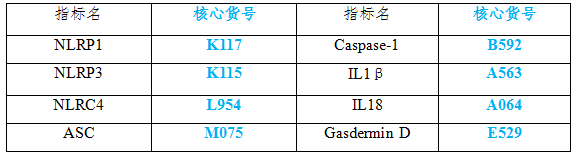
云克隆也开发了炎症小体相关产品,包括蛋白、抗体、ELISA试剂盒等,可助力广大科研工作者进行炎症小体相关研究,部分指标节选如下,供参考。
更多信息,欢迎访问http://www.cloud-clone.com/。