挑战Warburg效应——肿瘤微环境中的营养分配
挑战Warburg效应——
肿瘤微环境中的营养分配
著名科学家奥托·瓦博格(Otto Warburg)19世纪20年代发现:肝癌细胞的糖酵解活性显著高于正常肝细胞。一般来说,细胞糖代谢有两种途径:线粒体氧化磷酸化和糖酵解。在氧气充足的情况下,正常细胞代谢通过线粒体氧化磷酸化,糖酵解被抑制;而癌细胞即使供氧充足时糖酵解却依然活跃。这种肿瘤细胞高效消耗消耗葡萄糖的代谢特征,就是“Warburg Effect”。很多科学家希望通过抑制“Warburg Effect”来阻止糖酵解,以阻止肿瘤发展的进程,却少有成功案例。
直到今年4月份,《Nature》在线发表了“Cell-programmed nutrient partitioning in the tumour microenvironment”一文。该研究发现:肿瘤微环境中疯狂摄取营养的是免疫细胞,并非肿瘤细胞,免疫细胞存在更高的对葡萄糖的代谢水平。这一发现与百余年来“Warburg Effect”所认同的肿瘤微环境中肿瘤细胞高代谢葡萄糖的特征有所出入。
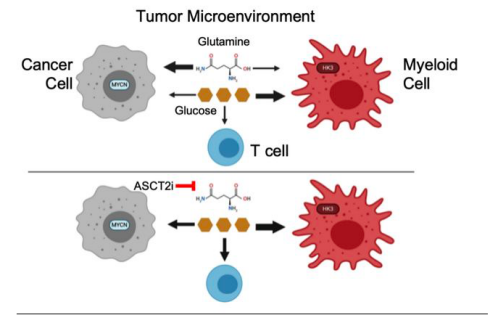
图1. 肿瘤微环境
肿瘤浸润的免疫细胞代谢依赖于葡萄糖,而在肿瘤微环境中受损的免疫细胞代谢则有助于肿瘤细胞逃逸。然而,我们尚不清楚在肿瘤微环境中免疫细胞的代谢失调是通过细胞内源性程序失调还是通过与癌细胞争夺有限的营养素而失调的。
该研究通过正电子发射断层扫描(PET)示踪多种肿瘤模型中肿瘤细胞对葡萄糖和谷氨酰胺摄取量,并通过流式细胞术对肿瘤组织中的细胞进行大致分类(CD45-细胞主要为癌细胞,CD45+细胞为免疫细胞)。研究发现:免疫细胞对葡萄糖的摄取量最高,而肿瘤细胞对谷氨酰胺的摄取量最高。同时,免疫组化实验证明营养物质的摄取量差异不是由免疫细胞在肿瘤微环境中表达部位不同所致。

图2. 免疫细胞与癌细胞摄取的葡萄糖
研究者进一步研究肿瘤微环境中肿瘤细胞对谷氨酰胺和葡萄糖摄取的关系。用V-9302(一种有效抑制谷氨酰胺摄取的试剂)处理后的细胞,谷氨酰胺的摄取量明显降低,但肿瘤细胞葡萄糖的摄取量明显升高。也就是说,当谷氨酰胺的摄取被抑制时,肿瘤细胞葡萄糖摄取会明显提升,即:肿瘤细胞的内在程序决定了肿瘤微环境对葡萄糖和谷氨酰胺的摄取。
既然已经证实了免疫细胞比肿瘤细胞摄取更多的葡萄糖,那么,这些摄取量的不同又是由什么信号通路决定的呢?mTORC1 信号通路的功能失调会引起包括肿瘤在内的多种疾病,营养物质如氨基酸是mTORC1的重要激活因子。该研究发现:mTORC1参与了肿瘤微环境中葡萄糖的摄取和代谢。
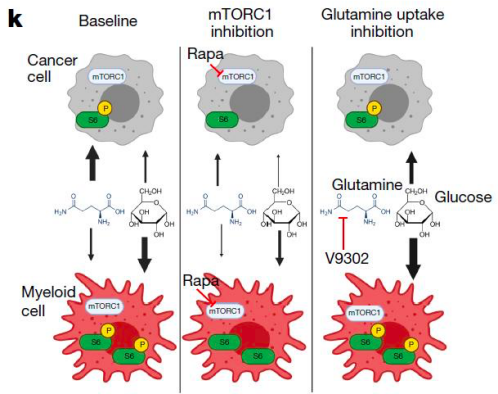
图3. mTORC1参与肿瘤微环境中葡萄糖的摄取和代谢
这一研究揭示了肿瘤微环境中不同细胞会吸收不同的营养,有助于阐明肿瘤发生发展的机制,有助于进一步开发特异性的靶向治疗方法。
云克隆相关靶标展示:
靶标 | 核心货号 | 靶标 | 核心货号 |
CD45 | B030 | CD11b | B685 |
CD3d | B872 | CD3e | D117 |
CD3g | D118 | Glucose | X062 |
CD68 | B257 | Lactic Acid | V643 |
CD4 | B167 | CD8a | B099 |
p53 | A928 |