ILTCKs——有望突破免疫疗法困境
肿瘤细胞突变产生的新生抗原可被CD8+ 细胞毒性T细胞识别,进而杀死肿瘤。然而,狡猾的肿瘤细胞可通过上调PD-L1,抑制CD8+ T细胞的功能,甚至诱导其耗竭。近年来,靶向抗体在抗肿瘤方面取得了巨大成功,然而其疗效受制于肿瘤新生抗原量的影响。因此,有必要研究癌症免疫监测的替代机制。
2022年4月美国纪念斯隆-凯特琳癌症中心李明教授及团队在《nature》杂志上发表题为“Programme of self-reactive innate-like T cell-mediated cancer immunity”的文章,发现了一种类先天性杀伤型T细胞(innate-like T cells with high cytotoxic potential,ILTCKs),该群T细胞缺乏PD-1却高度表达自然杀伤细胞受体,不依赖于树突状细胞且对肿瘤细胞具有强大的细胞毒性,极具抗癌潜力,有望成为癌症免疫疗法新的方向。早在2016年,研究人员就报道了ILTCKs的存在并揭示了其抗癌活性,但对其来源及作用机制还不清楚。这篇文章对其来源及作用机制进行了深入研究。

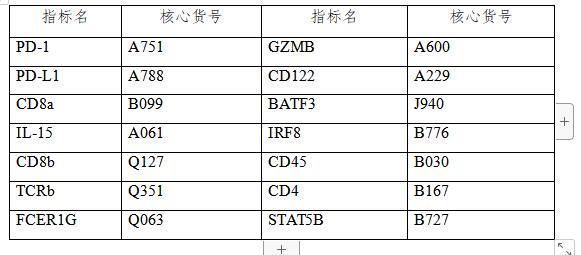
研究人员首先利用单细胞RNA测序(single-cell RNA-sequencing,scRNA-seq)分析了MMTV-PyMT (PyMT) 小鼠乳腺肿瘤组织的CD45+ TCRβ+ CD8α+细胞,揭示该种细胞分为5个不同的集群。C1群表达naive T细胞的标志物如Il7r 、Tcf7,可能还含初始活化的T细胞。C2细胞集群高表达T细胞耗竭相关标志物,包括Pdcd1(编码PD-1)、Tox。C3细胞集群即αβTCR谱系ILTCKs (αβILTCKs ),高表达Gzmb、Klrb1c (编码NK1.1 )和Fcer1g。C4细胞集群高表达I型干扰素刺激基因如Isg15和Ifit3。C5细胞集群Mki67和Top2a表达上调,提示其处于增殖状态。上述试验表明,PyMT小鼠肿瘤浸润的CD8α+ T细胞处于不同的分化和增殖状态。研究人员为推断ILTCKs潜在的分化轨迹时,对5群细胞做三维细胞聚类图后分析,发现C1(naive/初始活化T)与C2细胞集群(耗竭T)之间存在大量混合,C3(αβILTCKs)和C5(增殖T)与C1细胞集群分离距离相对较远(图1),提示αβILTCKs是一群独特分化的抗肿瘤T细胞。
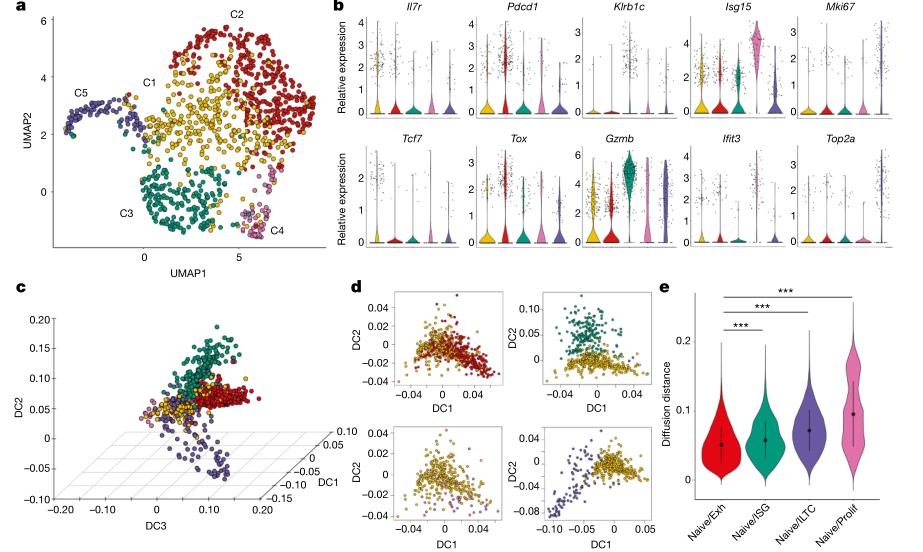
图1. 肿瘤浸润CD8 + T细胞的特征(图片来源于《Nature》杂志)
研究人员未检测到肿瘤患者NK1.1+CD8α+ αβILTCKs与常规PD- 1+ CD8α+ T细胞(PD-1 + T细胞)使用共同的TCR对。在进一步将naive CD8+ T的TCR替换成αβILTCKs来源的TCR,转移至荷瘤受体小鼠后,发现CD8 + T细胞PD - 1表达上调,而NK1.1表达下调,提示常规 CD8+ T细胞不能改造成αβILTCKs。研究人员还发现,在αβILTCK-TCR特异性骨髓嵌合体荷瘤小鼠的肿瘤中,αβILTCK特异性TCR能持续特异性产生NK1.1 +αβILTCKs,而不是PD - 1 + T细胞(图2)。上述结果提示,αβILTCKs与常规CD8 + T细胞是完全不同的两群细胞,二者可能源于胸腺细胞发育过程中TCR特异性的选择。
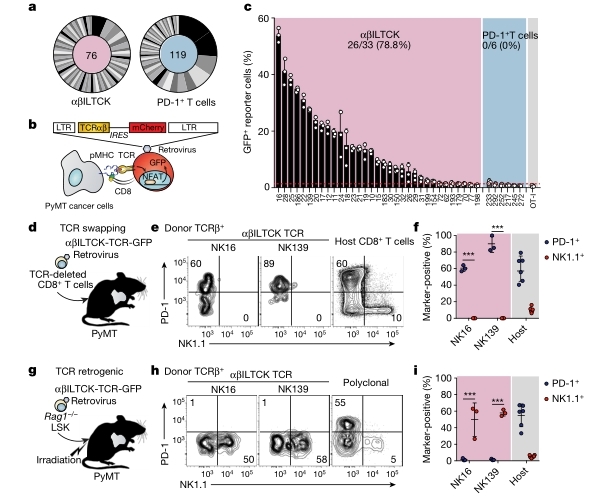
图2. 在胸腺发育过程中,αβILTCK与常规CD8 + T细胞呈现出不同的TCR特异性分化(图片来源于《Nature》杂志)
值得注意的是,常规CD8+ T细胞应答需要BATF3-和IRF8-依赖的常规1型树突状细胞( cDC1s )的提呈,而肿瘤内NK1.1 + αβILTCKs应答不依赖于cDC1s,提示αβILTCKs的特性更接近先天淋巴细胞。此外,研究人员利用TCR分析系统发现,在33个NK1.1+ αβILTCKs来源的TCRs中,有26个( 78.8 % )对PyMT肿瘤细胞表现出不同程度的反应性,提示αβILTCKs可识别多只小鼠共有的未变肿瘤抗原(原生抗原),而PD-1+ T来源的TCRs则不能识别肿瘤原生抗原(图2)。因此,αβILTCKs可以对原生抗原遍布的肿瘤细胞发挥作用,且不发生PD-1相关的细胞耗竭,是一种存在持续抗癌潜力的T细胞。
那么,ILTCKs为何可以针对性的识别肿瘤细胞,却不影响正常健康组织呢?研究人员发现促炎性细胞因子IL-15是关键因素之一。首先,IL-15敲除的小鼠几乎完全缺失FCER1G+ CD122+胸腺αβILTCK前体细胞,提示NK1.1 + αβILTCKs的发育高度依赖于IL-15。其次,与健康组织相比,肿瘤组织(乳腺癌和结肠癌患者)中IL-15表达水平显著增高;在癌组织中,FCER1G+ (αβILTCK谱系表达标记)而非PD-1+ T细胞出现的频率与IL-15量呈正相关。利用S100a8-cre-Il15fl/fl PyMT小鼠(乳腺上皮细胞中IL-15选择性敲除),研究者发现其胸腺FCER1G+ CD122+ αβILTCK祖细胞水平与对照组相似,但肿瘤浸润的αβILTCKs数量减少,表达NK1.1和GZMB 的水平减少,且癌细胞IL-15选择性敲除后,肿瘤生长速度明显加快(图3)。上述结果提示,ILTCKs可感知癌细胞来源的IL- 15用于癌症免疫监视。研究人员进一步将STAT5B - CA(主要协调IL-15信号通路转录程序下游的转录因子STAT5B活化形式)导入淋巴细胞缺陷的荷瘤PyMT小鼠后,对小鼠肿瘤有明显的抑制作用;将STAT5B-CA介导的αβILTCK祖细胞移植到PyMT宿主体内后,减少了肿瘤的生长。因此,IL-15信号通路对ILTCKs的细胞毒性的维持至关重要,癌组织IL-15水平远高于健康组织这一特性可使ILTCKs针对性地清除癌细胞。

图3. αβILTCKs感知肿瘤细胞表达的IL - 15并抑制肿瘤生长(图片来源于《Nature》杂志)
因此,ILTCKs即可以识别原生抗原,也可以避免诱发自身免疫病,其在细胞毒性及抗细胞耗竭方面优于传统CD8+ T细胞。ILTCKs的独特表现有望为实体肿瘤提供新的解决方案,进一步优化现有的免疫疗法。
云克隆开发了相关的靶标产品,可助力广大科研工作者进行肿瘤相关研究,部分指标节选如下,供参考。