继“铜死亡”,探讨铜积累的危害
获取、分配及消除铁、铜等金属微量营养素对于生命的维持至关重要。铜是多种酶的辅助因子,为多种生物学过程所必需,包括线粒体呼吸、抗氧化防御和生物化合物合成等。尽管机体对铜有生理需求,但过量的铜积累却具有细胞毒性。前期介绍了铜过量诱导细胞铜死亡的机制,本文进一步探讨铜积累相关的病理机制。
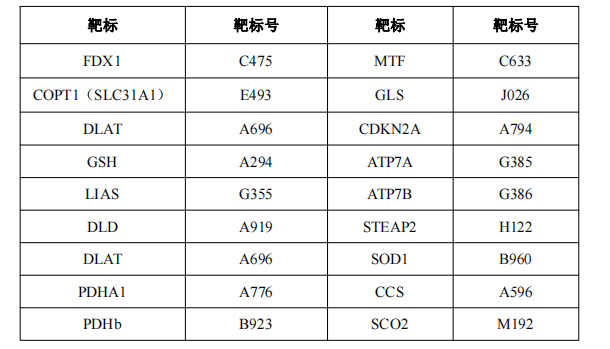
铜积累触发铜死亡 细胞内铜离子积累通过两种方式:一方面是铜离子载体将Cu2+运输到细胞内,通过铁氧还原蛋白1(FDX1)将Cu2+还原成Cu+;另一方面,Cu+通过铜导入剂SLC31A1进入细胞内(Cu+也可以通过导出剂ATP7B导出细胞)。亲水性抗氧化剂谷胱甘肽(GSH)通过螯合细胞内的Cu+来阻断铜毒性,但当胞内铜离子过度积累后,可促进参与调节线粒体三羧酸循环的酶(特别是二氢硫辛酸转乙酰基酶(DLAT))发生脂酰化并与之结合,从而形成长链和团块化,导致细胞死亡;同时也会干扰铁硫簇,导致铁硫蛋白下调,介导细胞毒性应激并死亡(见图1)。铜积累可引起多种细胞死亡,铜死亡机制明显区别于已知的细胞凋亡、焦亡、坏死性凋亡以及铁死亡等多种细胞死亡机制。目前,已有研究报道与铜死亡代谢途径相关的基因有:铁氧还原蛋白1(FDX1)、硫辛酸合酶(LIAS)、脂肪酸转移酶1(LIPT1)、二氢硫辛酸脱氢酶(DLD)、二氢硫辛酸转乙酰基酶(DLAT)、丙酮酸脱氢酶E1-α亚基(PDHA1)、丙酮酸脱氢酶β亚基(PDHB)、金属调控转录因子1(MTF)、谷氨酰胺酶(GLS)、细胞周期依赖性激酶抑制剂2A(CDKN2A)。
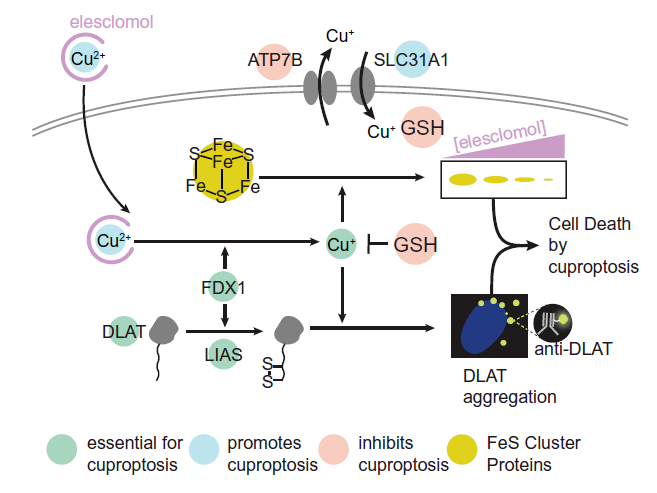
图1 铜死亡信号传导(图片源自《Science》杂志)
铜积累参与铜代谢异常疾病发病机制 在人体内,存在两种铜转运P型ATP酶——ATP7A和ATP7B,是维持细胞铜稳态的关键角色。人类ATP7A和ATP7B共享56%序列同源性,ATP7A对肠道的铜吸收具有关键性作用,相比之下,ATP7B在肝细胞中表达最丰富,可将多余的铜排泄到胆汁中。细胞内铜离子通过铜转运P型ATP酶导出途径见图2。当ATP7A和ATP7B发生突变时,细胞铜稳态失衡,可导致多种铜代谢异常疾病,如Menkes病和Wilson病。在Wilson病中,ATP7B功能障碍会导致病理性铜聚集,铜离子可以抑制ATG4B的活性,而ATG4B在自噬过程中发挥重要作用,因此,铜离子积累可抑制细胞自噬。铜积累与细胞自噬之间的相互作用参与了Wilson疾病的发病机制。
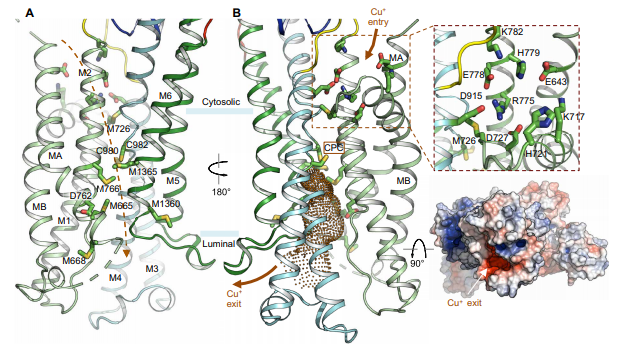
图2 铜离子转运途径(图片源自《Science Advances》杂志)
铜积累驱动肿瘤发展 在已有报道中发现铜离子水平在多种癌症中呈现异常升高趋势,包括:乳腺癌、肺癌、甲状腺癌、结肠癌、肝癌等,肿瘤的生长和转移对于铜这种金属营养物质有更高的需求(见图3)。在这些癌症中出现铜积累现象,不仅没有触发细胞铜死亡,反而激活了促细胞增殖途径,参与驱动癌症的病理特征。因此,推测癌细胞的代谢重组可能有利于铜依赖的促生长信号通路激活。血液中的高浓度铜离子与肿瘤发生、化疗耐药及不良的预后反应有关,已有研究构建了与铜死亡基因FDX1相关的铜死亡相关风险评分系统,对肝癌患者临床特征及预后进行分析,发现铜死亡相关风险系统对肝癌的化疗以及免疫治疗方面具有重要的指导意义。目前已有多种新型抗癌铜基药物处于临床试用阶段,相关药物研发的主要策略为合成铜配合物,螯合血液中的铜。不同类型的铜配合物抗癌药物的作用机理不尽相同,有待深入挖掘。
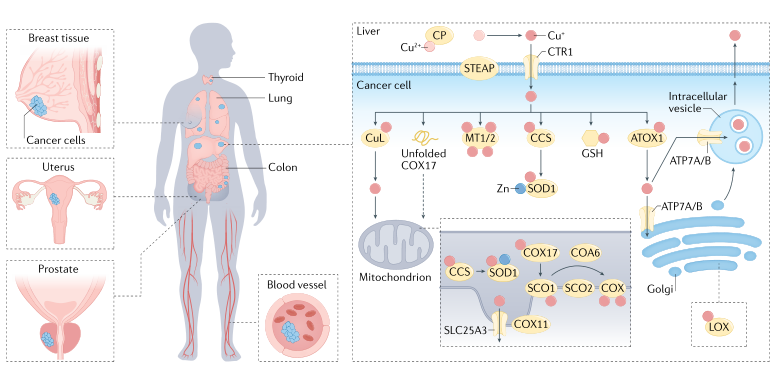
图3 铜离子在癌细胞中的分布及相关分子途径(图片源自《Nature Reviews Cancer》杂志)
综上,细胞内铜积累可诱导细胞死亡及铜代谢异常相关疾病,维持机体铜稳态对于生命健康具有重要意义。探讨铜积累在细胞中发挥的作用及机制有利于为相关疾病的治疗提供更多新视角。
云克隆开发了该文章中涉及的相关靶标产品,靶标如下,供参考: