第二回:TSLP与过敏的紧密关系
在第一回中,我们介绍了TSLP与肿瘤的关系,这一回我们将介绍TSLP与过敏的关系。
研究表明,TSLP与过敏性皮炎、过敏性哮喘等密切相关。人TSLP有两种变体:长型(lfTSLP)和短型(sfTSLP),分别由159个氨基酸和63个氨基酸组成。lfTSLP就是我们通常说的TSLP。sfTSLP的转录始于内含子2中的一个启动子,因此在氨基端被截断,缺失了96个氨基酸,但与lfTSLP具有相同的羧基端。sfTSLP主要在一些正常组织如肠上皮细胞、皮肤表皮细胞中表达,在炎症状态下,表达下调。sfTSLP的作用尚未研究清楚,可能作为口腔和皮肤上的抗菌肽来发挥作用,可抑制包括TNFα、IL1β、IL6在内的多种细胞因子的产生,发挥稳态作用。与sfTSLP相反,lfTSLP在哮喘、肠炎和过敏性皮炎等病理状态下表达上调,在正常组织中低表达。lfTSLP能增强CD11c+树突状细胞的成熟,可通过直接激活肥大细胞诱发过敏性炎症。还可通过增加IFNγ释放并激活TSLPR而介导炎症反应。
近些年来,过敏和哮喘的发病率呈增高趋势。早年罹患特异性皮炎的患者日后更易出现食物过敏与哮喘。Th2优势免疫是过敏和哮喘的重要临床特征,而TSLP介导了Th2优势免疫。目前已确定TSLP在过敏性疾病的发展中发挥着关键作用(见图1)。
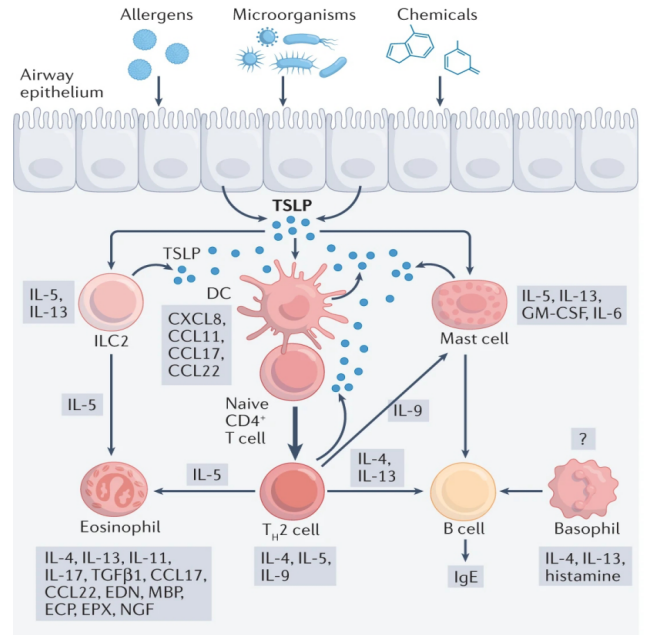
图1. TSLP与过敏的关系(图片来源于《Nature Reviews Immunology》杂志)
在特应性皮炎(AD)患者皮肤病变处的角质形成细胞中检测到大量TSLP的表达,但是在健康人及特应性皮炎患者的非病变皮肤中未检测到TSLP。同时,患者破损皮肤中还测到了高表达的IL1β、IL4、IL13和TNFα,这些细胞因子的表达也可诱导TSLP的产生。人角质细胞和鼻上皮细胞中TSLP的表达水平可通过组胺(Histamine,过敏性疾病的关键介质)与组胺H4受体(HRH4)结合而增加。此外,实验小鼠模型显示上皮角化细胞中Notch信号的缺失会破坏小鼠皮肤屏障的完整性,产生类似于创伤的微环境,高表达的TSLP介导了Th2型炎症免疫,使小鼠患有与特应性皮炎患者相似的皮肤病。这项研究表明TSLP在特应性皮炎中异常高表达可能与Notch信号缺失有关。
食物过敏通常是由于产生抗原特异性lgE抗体,在过敏原的刺激下,产生TSLP、IL25及IL33,同时刺激先天性淋巴细胞,产生Th2细胞因子,进而引起免疫系统的免疫过激反应。皮内注射TSLP可诱发小鼠食物过敏,促进消化道炎症反应。相反,降低TSLP水平,肠道食物过敏的易感性下降。TSLP能刺激树突状细胞(DC)成熟和激活,促进CD4+Th0细胞向Th2细胞增殖和分化,在外周血和食道中分泌大量Th2细胞因子。TSLP与自然杀伤T细胞(NKT细胞)的TSLPR结合,可显著诱导NKT细胞产生大量IL13,进而生成IgE,介导机体产生牛奶蛋白过敏反应。
哮喘属于过敏进程的下游疾病,在小鼠哮喘模型中,TSLP能激活NKT细胞,产生IL13;激活肥大细胞,产生IL1β、IL5、IL8等。进而通过IL5、CCL24募集嗜酸性粒细胞,通过IL8募集中性白细胞,加重气道炎症的发生发展。经皮致敏的AD小鼠,过敏原激发可引起气道炎症和气道高反应性。过表达TSLP可破坏气道屏障功能,促进气道炎症发生发展,而降低TSLP表达水平则可显著改善气道炎症和气道高反应性。哮喘患者,尤其是严重哮喘患者,气道中TSLP和TH2细胞因子水平均升高。
虽然目前有哮喘控制药物,包括吸入糖皮质激素和长效支气管舒张剂等,但许多重度哮喘患者的病情并未得到有效控制。另外,许多重度哮喘患者由于长期使用慢性口服皮质类固醇,引发了很多皮质类固醇相关的不良反应。临床迫切需要更安全且覆盖人群更广的重度哮喘治疗药物。目前已有TSLP单抗药物可用于治疗重度哮喘,比如Tezepelumab。Tezepelumab是人源IgG2单克隆抗体,美国FDA于2021年批准Tezepelumab用于治疗严重哮喘。其与TSLP结合后能阻止TSLP与其受体复合物的结合,阻止靶向的免疫细胞释放促炎性细胞因子,进而防止哮喘急性加重。且Tezepelumab在重症哮喘患者中表现出良好的耐受性,其安全性与安慰剂相比无统计学意义的差异(见图2)。由于TSLP单抗药物在治疗重度哮喘中的优势,目前也有很多公司致力于开发TSLP抗体药物用于治疗特异性皮炎、过敏性鼻炎等。
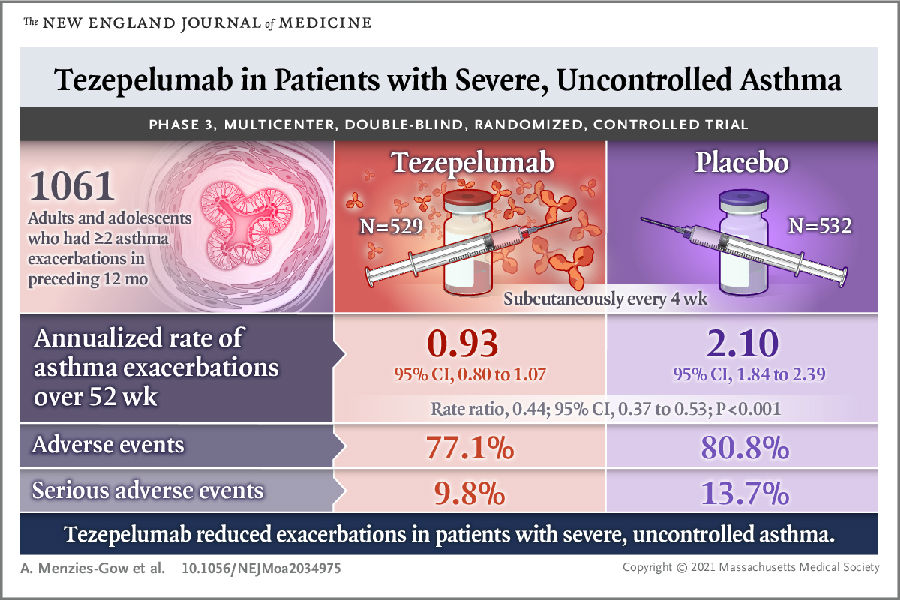
图2. TSLP单抗药物Tezepelumab用于治疗重症哮喘
(图片来源于《The New England Journal of Medicine》杂志)
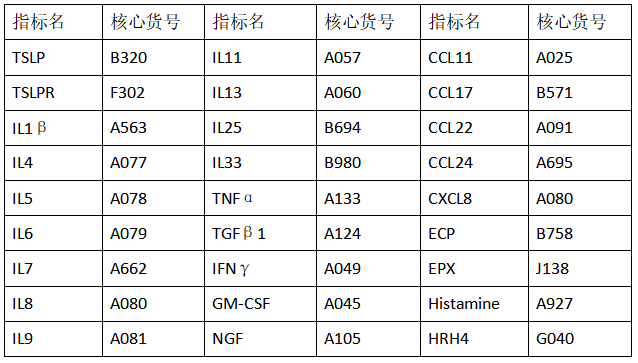
云克隆开发了TSLP及过敏的相关靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/