多发性硬化症机制研究新发现
多发性硬化症(MS)是一种中枢神经系统(CNS)的自身免疫性疾病,其特点是脱髓鞘、轴索损伤和进行性神经功能障碍。MS可影响大脑、脊髓和视神经,主要症状包括疲劳、运动功能障碍、麻木、协调性或平衡性丧失、语言和视觉障碍、认知障碍和急性瘫痪,是青壮年非创伤性致残最常见的原因之一。尽管遗传和环境因素都参与其中,但MS的病因和发病机制复杂,仍然难以捉摸。近期,多篇文献报道MS病理机制相关研究,可能为MS的预防和治疗提供帮助。
1. MS与肠道微生物
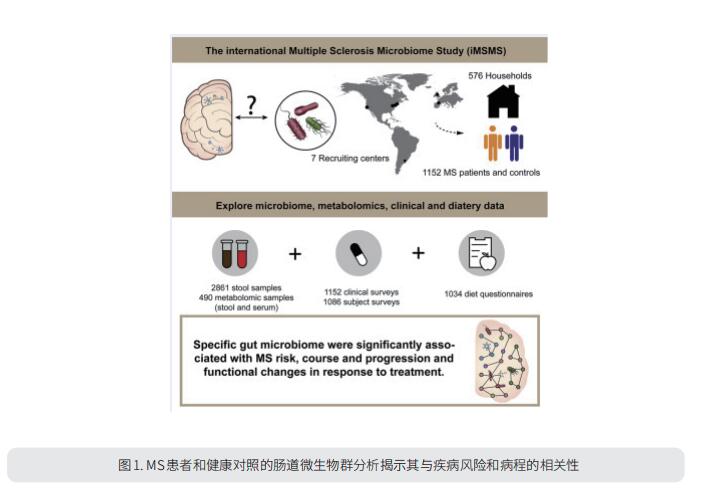
肠道微生物群的变化与多种疾病有关。国际MS微生物组研究团队研究了576名MS患者(36%未经治疗)以及与遗传无关的家庭健康对照组(总共1152名受试者)的肠道微生物组(图1)[1]。他们观察到MS患者肠道菌群中Akkermansia muciniphila、Ruthenibacterium lactatiformans、Hungatella hathewayi和Eisenbergiella tayi的比例显著增加,Faecalibacterium prausnitzii和Blautia species的比例显著降低。在未经治疗的MS患者中,植酸降解途径占比过高,而产生丙酮酸的碳水化合物代谢途径显著减少。此外,干扰素-β的治疗活性可能部分与短链脂肪酸转运体的上调有关。这些结果有力地支持特定的肠道微生物组与MS风险、病程和进展以及治疗后的功能变化有关。
2. MS与EB病毒
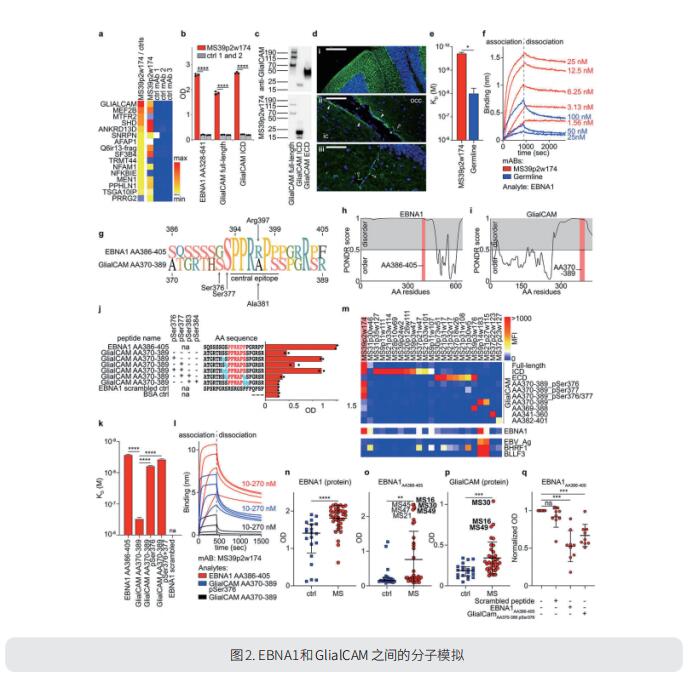
爱泼斯坦-巴尔(EB)病毒感染在流行病学上与多发性硬化症有关,但其病理作用仍不清楚。美国斯坦福大学医学院免疫与风湿病学系William H. Robinson团队证明了EBV转录因子EBNA1和中枢神经系统蛋白GlialCAM之间的高亲和力分子模拟(图2),并为其相关性提供了结构和体内功能证据[2]。首先通过对MS血液和脑脊液(CSF)的B细胞库进行单细胞测序,然后基于蛋白质微阵列对针对MS相关病毒的CSF源性抗体进行检测,确定了一种交叉反应性CSF源性抗体。他们通过序列分析、亲和力测量以及EBNA1肽表位与自体Fab片段复合的晶体结构追踪幼稚的EBNA1限制性抗体向成熟的EBNA1/GlialCAM交叉反应性抗体的发展。GlialCAM的翻译后修饰促进了分子模拟。EBNA1免疫加重小鼠MS模型症状,抗EBNA1/GlialCAM抗体在MS患者中普遍存在。这些发现为EB病毒感染和MS的病理生物学提供了一个机制上的联系,并可以指导新型MS疗法的开发。
3. MS与骨髓造血
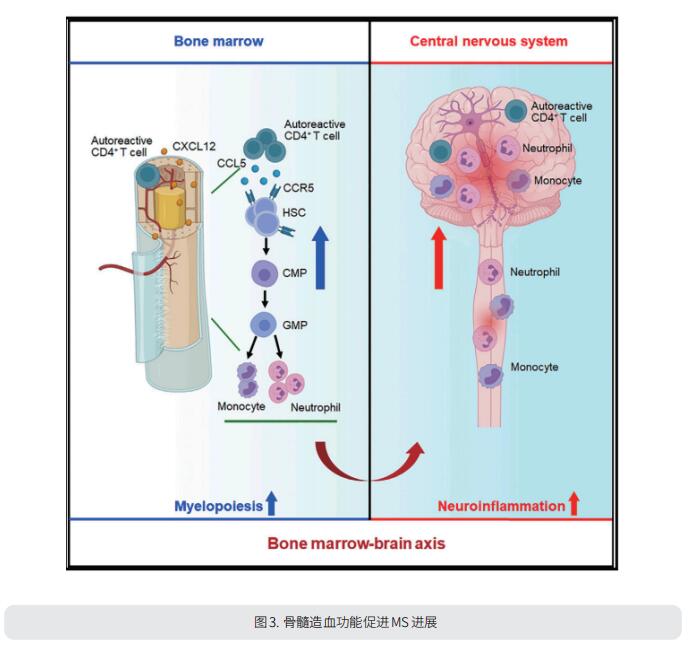
骨髓造血干细胞和祖细胞(HSPC)能迅速感知免疫激活,但在MS中它们与自体活性T细胞的潜在相互作用尚不清楚。天津医科大学总医院神经免疫学研究所神经内科Qiang Liu团队报道了在MS患者中,随着T细胞的克隆扩增,骨髓HSPC向髓系倾斜[3]。在实验性自身免疫性脑脊髓炎(MS模型)的小鼠模型的谱系追踪中,骨髓造血显著,侵入中枢神经系统的中性粒细胞和Ly6Chigh单核细胞的输出增加。他们发现髓鞘反应性T细胞以CXCR4依赖的方式优先迁移到骨髓腔室。这种异常的骨髓造血涉及CCL5-CCR5轴,并增加中枢神经系统炎症和脱髓鞘(图3)。这一研究表明,针对骨髓微环境是治疗MS和其他自身免疫性疾病的一个途径。
参考文献
[1] iMSMS Consortium. Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course [J]. Cell. 2022;185(19):3467-3486.e16. (IF=66.850)
[2] Lanz TV, Brewer RC, Ho PP, et al. Clonally expanded B cells in multiple sclerosis bind EBV EBNA1 and GlialCAM [J]. Nature. 2022;603(7900):321-327. (IF=69.504)
[3] Shi K, Li H, Chang T, et al. Bone marrow hematopoiesis drives multiple sclerosis progression [J]. Cell. 2022;185(13):2234-2247.e17. (IF=66.850)
云克隆不仅可提供多种自身免疫疾病动物模型,包括变态反应性脑脊髓炎、干燥综合征、系统性红斑狼疮、类风湿性关节炎等,涵盖常见自身免疫疾病;还具有各类自身免疫疾病检测指标及上述CXCR4、CCL5、CCR5等相关产品,可助力广大科研工作者进行自身免疫疾病研究。