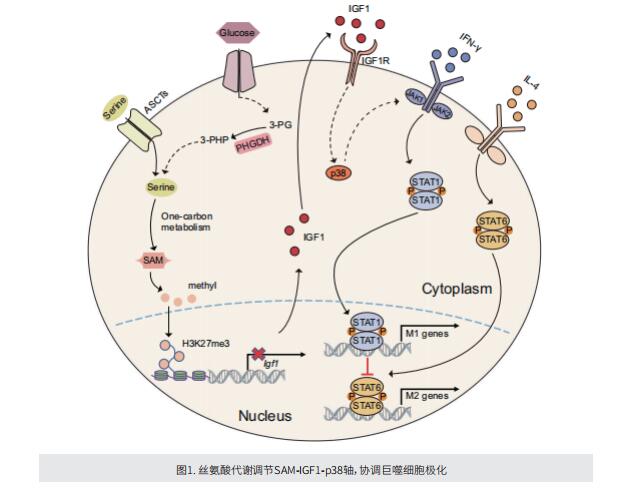
文献解读 | 丝氨酸代谢通过调节IGF1–p38轴协调巨噬细胞极化

2022年9月30日,天津医科大学第二医院传染病科Qiujing Yu团队在《Cellular & Molecular Immunology》上发表题为“Serine metabolism orchestrates macrophage polarization by regulating the IGF1–p38 axis”的文章,这项研究揭示了丝氨酸代谢协调巨噬细胞极化的新机制。

在这篇文章中,云克隆试剂盒【S-腺苷蛋氨酸(SAM)检测试剂盒(酶联免疫吸附试验法),CEG414Ge】受到科研工作者的认可,荣登优秀国际期刊。


被极化为不同激活状态的巨噬细胞在宿主防御、炎症和肿瘤发展等过程中发挥不同的功能。越来越多的研究表明巨噬细胞的激活与细胞代谢的变化密切相关。在巨噬细胞激活过程中,各种代谢途径被重新编程以适应细胞功能的变化,从而促进专门的免疫表型。据报道,丝氨酸代谢与免疫细胞功能有关,但丝氨酸代谢是否以及如何调节巨噬细胞极化仍在有待研究。
在这项研究中,作者旨在阐明丝氨酸代谢如何通过胰岛素样生长因子1(IGF1)-丝裂原激活蛋白激酶14(p38)轴影响巨噬细胞极化。首先,通过基因消融或用抑制剂CBR-5884处理,阻断丝氨酸生物合成途径中的关键酶磷酸甘油酸脱氢酶(PHGDH)的活性,在体外和体内均显著增强了M1巨噬细胞被干扰素γ(M(IFN-γ))极化,但抑制了M2巨噬细胞被IL-4(M(IL-4))极化。此外,限制外源丝氨酸和甘氨酸也产生了类似的效果。机制上,抑制内源性和外源性丝氨酸代谢通过减少s-腺苷蛋氨酸(SAM)介导的组蛋白H3赖氨酸27三甲基化(H3K27me3)促进IGF1的表达。随后,IGF1激活了p38依赖性Janus激酶(JAK)信号转导和转录激活因子1(STAT1)轴,从而促进M(IFN-γ)极化,并抑制向STAT6介导的M(IL-4)表型的极化。
综上所述,这项工作揭示了丝氨酸代谢在协调巨噬细胞极化中的重要作用,并建议将丝氨酸代谢作为巨噬细胞介导的免疫疾病的治疗策略。