疼痛机制研究新发现
国际疼痛研究协会将疼痛定义为与实际的或潜在的组织损伤相关联,或者可以用组织损伤描述的一种不愉快的感觉和情绪上的体验。急性疼痛主要作为报警信号,提醒人们及时就医或避免危险。大多数急性疼痛随着原发疾病的恢复而缓解。然而,慢性顽固性疼痛是一种不适应的疾病,严重损害患者生活质量。疼痛可能由多种机制引起,这种复杂性反映了实现显著缓解的困难。近期,多篇文献报道了疼痛机制相关研究,可能为新型疼痛治疗药物的开发提供帮助。
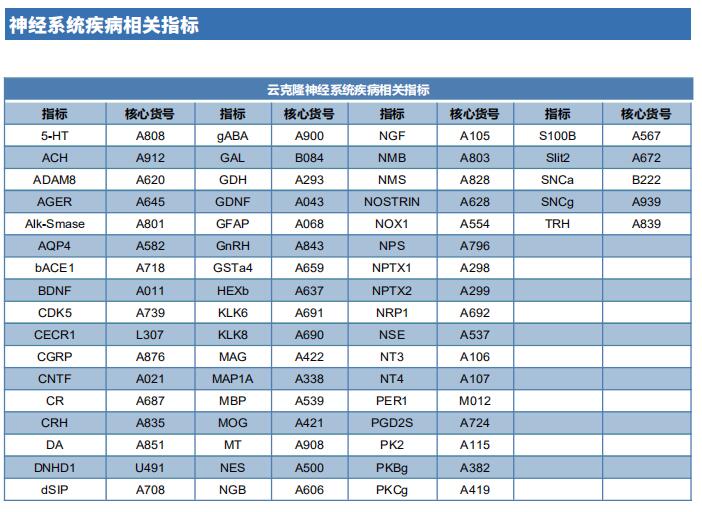
1. 抑制外周感觉神经元中的Hv1通道可减轻慢性炎性疼痛
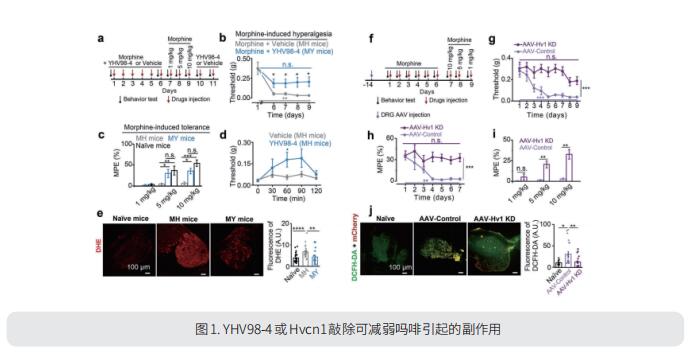
阿片类和非甾体抗炎药都会产生有害的副作用,并不能持续缓解慢性炎症疼痛。外周神经炎症(PN)对炎性疼痛的发生和发展至关重要。四川大学华西医院国家麻醉学转化医学地方联合工程研究中心Ruotian Jiang团队报道了质子选择性离子通道Hv1在啮齿动物和人类的外周感觉神经元中的表达[1]。神经细胞Hv1在PN或去极化刺激下上调,进而加重炎症和痛觉。通过基因或新发现的选择性抑制剂YHV98-4抑制神经元Hv1可以减少炎症性疼痛中细胞内的碱化和ROS的产生,缓解下游SHP-1-pAKT信号的失衡,还可以减少促炎趋化因子的释放,以缓解痛觉和吗啡诱导的痛觉过敏和耐受(图1)。因此,这些数据显示神经元Hv1是镇痛策略和阿片类药物相关副作用管理的新靶点。
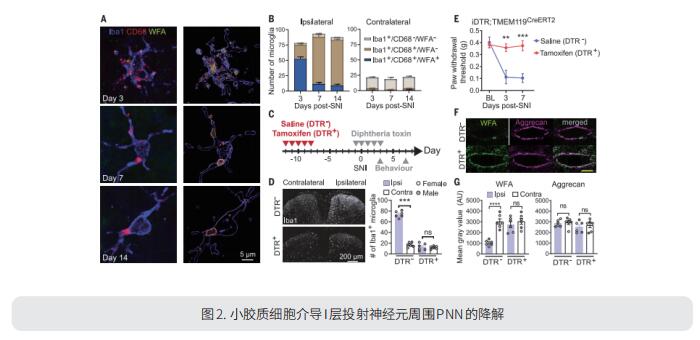
2. 小胶质细胞介导的周围神经网络降解促进疼痛
周围神经损伤后脊髓背角小胶质细胞的激活有助于疼痛超敏反应的发展。加拿大蒙特利尔麦吉尔大学麻醉学系Arkady Khoutorsky团队发现周围神经损伤后,小胶质细胞降解脊髓背角I层的细胞外基质结构神经周网(PNN)(图2)[2]。脊髓背角I型PNN选择性包裹脊髓旁肋投射神经元,该神经元整合脊髓中的痛觉信息,并将其传递到脊髓上脑区,诱发痛觉。小胶质细胞降解PNN可增强投射神经元的活性,诱导疼痛相关行为。因此,神经损伤诱导的PNN降解是小胶质细胞选择性增加脊髓痛觉回路输出并引起疼痛过敏的一种机制。
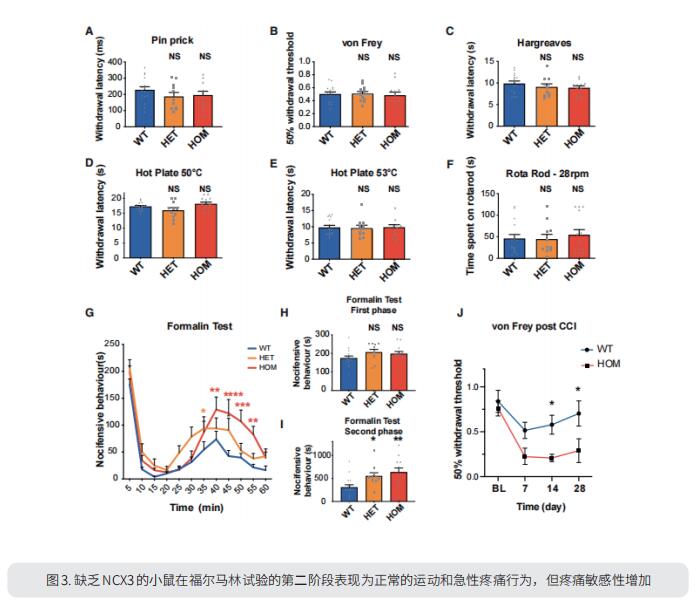
3. 钠钙交换体3调节慢性疼痛
反复使用有害刺激会导致疼痛感逐渐增强,这在临床疼痛障碍中得到验证。为了了解这一机制的遗传基础,英国牛津大学纳菲尔德临床神经科学系David L. Bennett团队对健康人类志愿者施加反复的刺激并记录疼痛等级,然后进行GWAS分析,发现与编码钠钙交换体3(NCX3)的SLC8A3有显著关联[3]。NCX3在小鼠背角神经元中表达,缺乏NCX3的小鼠表现为正常的急性疼痛,但在福尔马林试验的第二阶段表现出过敏和慢性压迫性神经损伤(图3)。缺乏NCX3的背角神经元在重复刺激后胞内钙增加,钙清除减慢,疼痛增加。此外,病毒介导的增强脊髓NCX3表达降低疼痛敏感性。这项研究强调Ca2+外流是持续性疼痛的潜在途径,这可能是治疗的靶向目标。
参考文献
[1]Zhang Q, Ren Y, Mo Y, et al. Inhibiting Hv1 channel in peripheral sensory neurons attenuates chronic inflammatory pain and opioid side effects [J]. Cell Res. 2022;32(5):461-476. (IF=46.297)
[2]Tansley S, Gu N, Guzmán AU, et al. Microglia-mediated degradation of perineuronal nets promotes pain [J]. Science. 2022;377(6601):80-86. (IF=63.714)
[3]Trendafilova T, Adhikari K, Schmid AB, et al. Sodium-calcium exchanger-3 regulates pain "wind-up": From human psychophysics to spinal mechanisms [J]. Neuron. 2022;110(16):2571-2587.e13. (IF=18.688)
云克隆不仅可提供偏头痛、牙齿激发痛、三叉神经痛等疼痛疾病动物模型,还具有各类炎性和疼痛应激相关血清指标检测产品以及上述SHP-1-pAKT信号通路相关产品,可助力广大科研工作者进行疼痛机制相关研究。