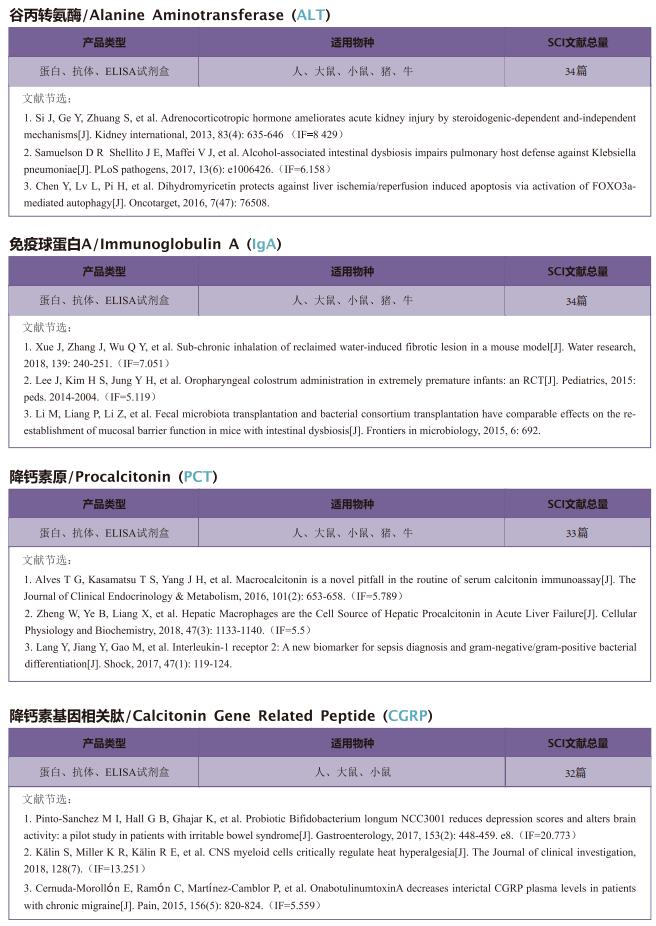
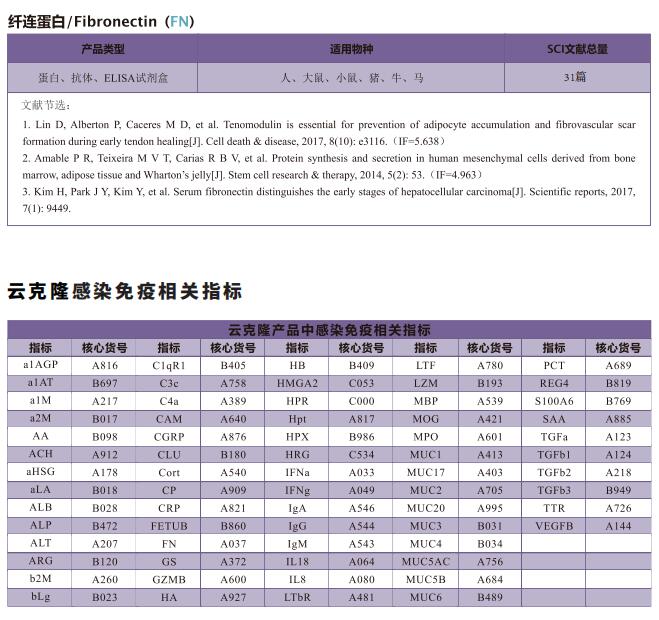
文献解读 | MT1-MMP介导ACE2脱落控制SARS-CoV-2感染

2022年12月23日,中国香港浸会大学中医学院Hoi Leong Xavier Wong团队在《Nature Communications》上发表题为“Control of SARS-CoV-2 infection by MT1-MMP-mediated shedding of ACE2”的文章,表明膜型1基质金属蛋白酶(MT1-MMP)有助于血管紧张素转换酶2(ACE2)的外结构域脱落,进而调控SARS-CoV-2感染。

在这篇文章中,云克隆试剂盒【血管紧张素转化酶2(ACE2)检测试剂盒(酶联免疫吸附试验法),SEB886Mu、SEB886Hu;基质金属蛋白酶14(MMP14)检测试剂盒(酶联免疫吸附试验法),SEC056Mu、SEC056Hu】受到科研工作者的认可,荣登优秀国际期刊。


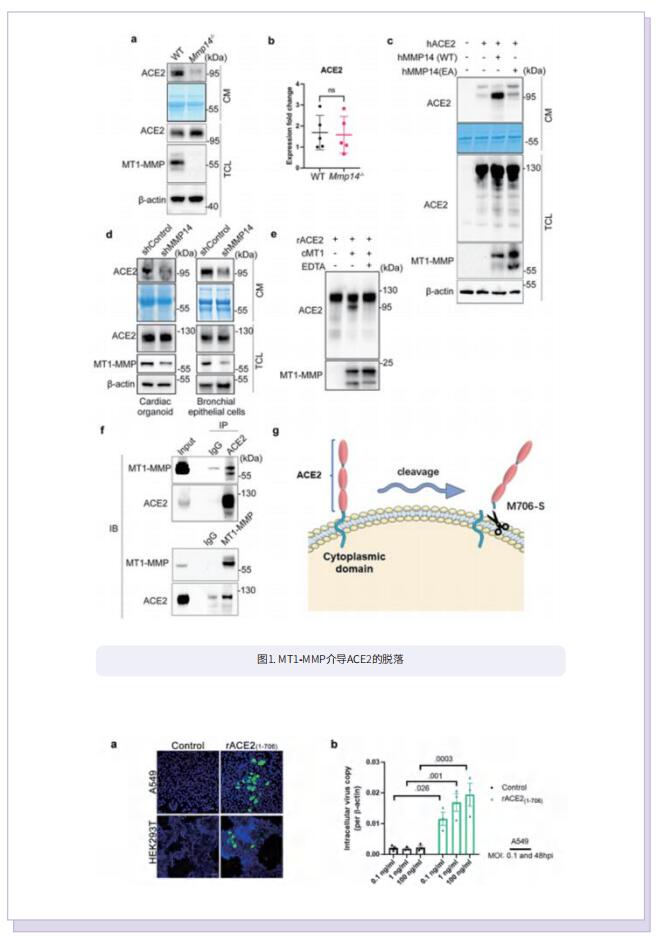
新冠肺炎是由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染引起的。已证实SARS-CoV-2的进入由刺突蛋白与血管紧张素转换酶2(ACE2)的结合介导。ACE2蛋白以两种主要形式存在,包括全长膜形式和脱落可溶性形式。然而,尚不清楚体内ACE2脱落的生理调控与SARS-CoV-2感染的关系。膜型1基质金属蛋白酶(MT1-MMP/MMP14)是一种膜结合的MMP。作者先前的发现以及其他研究表明,MT1-MMP在细胞表面蛋白的蛋白水解事件中起主要作用。因此作者设想,MT1-MMP可能有助于ACE2的外结构域脱落。
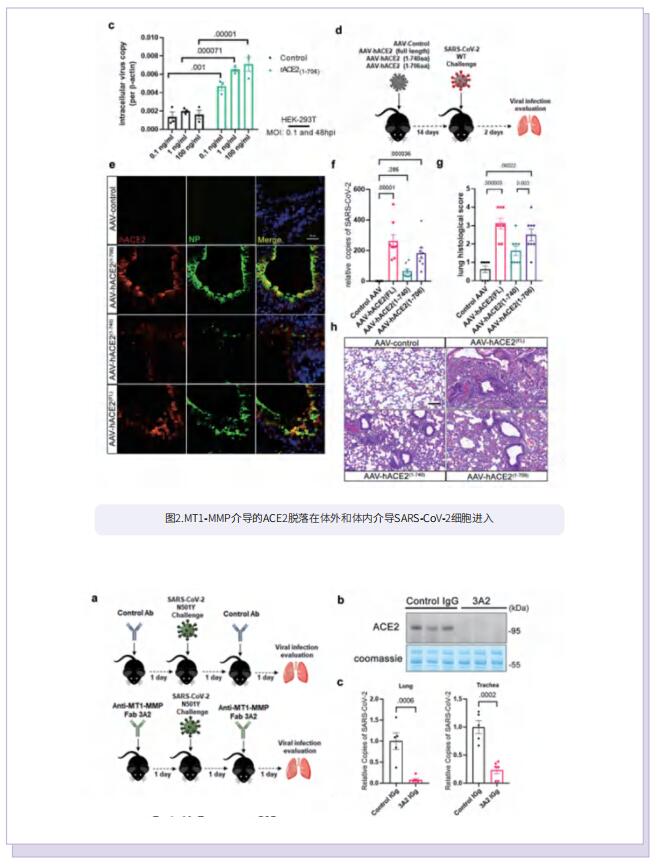
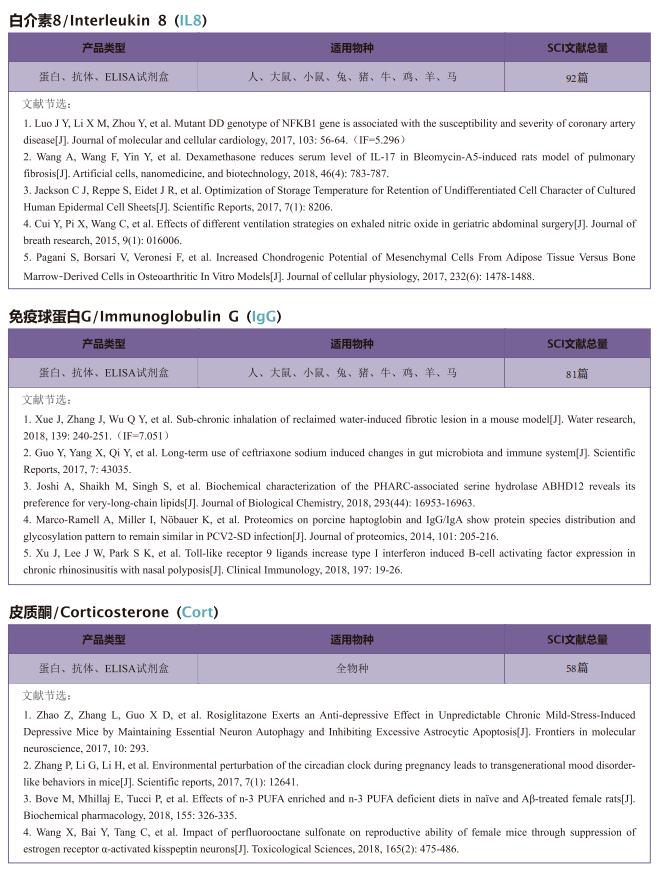
在这项研究中,作者确定MT1-MMP是可溶性ACE2介导的SARS-CoV-2感染的关键宿主蛋白酶。SARS-CoV-2感染导致人肺上皮中与ACE2共定位的MT1-MMP活化增加。从机理上讲,MT1-MMP直接切割膜形式ACE2以释放与SARS-CoV-2刺突蛋白结合的可溶性ACE2,从而促进SARS-CoV-2的细胞进入。人可溶性ACE2可使SARS-CoV-2在非容许细胞和自然不易感C57BL/6小鼠中感染。抑制MT1-MMP的活性可抑制人类器官和老年小鼠中可溶性ACE2介导的SARS-CoV-2定向进入。此外,老年小鼠和人血浆中可溶性ACE2和循环MT1-MMP均呈正相关。
综上所述,这项研究证明MT1-MMP是ACE2的主要代谢酶,可通过调控可溶性ACE2进而介导SARS-CoV-2感染。此外,MT1-MMP抑制对老年小鼠SARS-CoV-2感染的强大抑制作用揭示了MT1-MMP作为年龄相关感染易感性的主要宿主因素的潜在价值。