靶向TBK1——克服癌症免疫疗法耐药性
免疫疗法已经在黑色素瘤和一些癌症的治疗中得到很好的应用,然而克服治疗期间的耐药性仍然是一个挑战。2023年1月,Nature杂志上发表了一篇题为“Targeting TBK1 to overcome resistance to cancer immunotherapy”的文章,在这项研究中,研究者发现TANK结合激酶1(TBK1)作为一种免疫逃避基因,靶向TBK1可以降低效应细胞因子(肿瘤坏死因子α/干扰素γ,TNFα /IFNγ)的细胞毒性阈值从而增强对程序性死亡受体1(PD-1)阻断的反应,揭示了TBK1是一种有效的克服癌症免疫治疗耐药性的新靶点。

研究者通过CRISPR-Cas9敲除获得Tbk1缺失的小鼠黑色素瘤细胞(B16细胞),Tbk1缺失B16细胞和对照sgRNA B16细胞在植入免疫缺陷小鼠后以相同的速度生长。在携带对照和Tbk1缺失B16肿瘤的免疫活性野生型(WT)小鼠中,肿瘤的生长和存活率相当,经抗PD-1处理后,与携带sgRNA B16肿瘤的小鼠相比,携带Tbk1缺失B16肿瘤小鼠的肿瘤缩小和存活率增加。接着研究人员用药物处理携带B16 -ova(B16肿瘤表达模型抗原卵清蛋白)的肿瘤小鼠,发现与单药处理小鼠或对照小鼠相比,抗PD-1+TBK1i(TBK1抑制剂)处理的小鼠,肿瘤大小得到控制。使用B16-ova小鼠器官型肿瘤球状体(MDOTS)进行体外分析,结果显示抗PD-1+TBK1i处理导致细胞活性减少。D4M.3A(具有抗PD-1耐药性)肿瘤的MDOTS分析显示,TBK1i在黑色素瘤小鼠中能克服原发性(内在)耐药性,同时在B16-ova MDOTS中观察到类似的结果,该MDOTS来自于体内对PD-1阻断产生获得性(继发性)抗性的小鼠。这些发现表明TBK1i +抗PD-1在对PD-1阻断具有原发性(内在性)和继发性(获得性)耐药性的小鼠肿瘤模型中具有活性。(见图1)

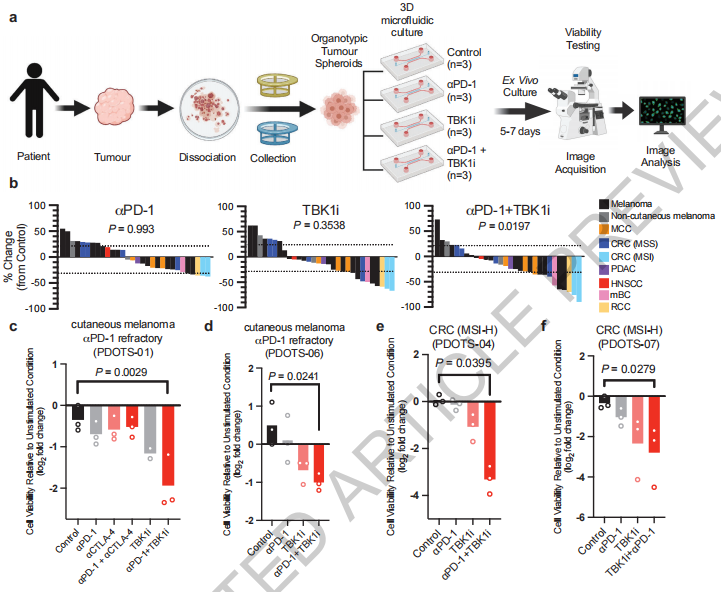
研究者对从黑色素瘤和其他癌症患者中分离的器官型肿瘤球状体(PDOTS)进行体外培养。对皮肤黑色素瘤(n=15)、非皮肤黑色素瘤(n=2)和其他癌症类型(n=13)患者的PDOTS(n=30)的分析显示,与单药PD-1阻断(16.6%)相比,TBK1i(30%)和TBK1i+PD-1阻断(40%)导致肿瘤生长减少。具有免疫治疗耐药性的转移性皮肤黑色素瘤患者的PDOTS对TBK1i +抗PD-1联合处理敏感,而对体外抗PD-1+/-抗CTLA-4联合处理无反应。在结直肠癌(CRC)和其他类型的癌症中也观察到PDOTS对TBK1i + PD-1阻断敏感。(见图2)
为了检测TBK1抑制对肿瘤免疫微环境的影响,研究者对使用抗PD-1、TBK1i或抗PD-1+TBK1i处理的小鼠提取CD45+细胞进行了scRNA-seq检测,发现抗PD-1处理增加了T细胞和NK细胞的数量,TBKi +/-抗PD-1处理组髓系细胞显著扩增。肿瘤浸润性髓系细胞的亚聚集显示,M1巨噬细胞的丰度显著增加,而某些免疫抑制髓系细胞群的丰度减少,包括髓系来源的抑制细胞(MDSCs)。研究人员还发现在TBK1i+/-抗PD-1处理的小鼠骨髓细胞簇中TNFα(Tnf)和IL-1α(Il1a)大量表达。TBK1i预处理增强了骨髓源性巨噬细胞(BMDMs)中Tnf和Il1a的表达,证实了TBK1抑制对骨髓细胞炎症反应的直接影响。(见图3)

研究者对203例转移性黑色素瘤患者进行免疫检查点封锁(ICB)治疗,两组中TNFα和IFNγ水平均升高。接着对接受ICB治疗的黑色素瘤患者的单细胞进行转录组测序,发现NR(无响应)组中TNFα和IFNγ的表达高于R(响应)组。IFNγ在衰竭的CD8 T细胞中表达最高,而TNFα主要在巨噬细胞/单核细胞中富集表达。与单独使用TNFα或IFNγ相比,TBK1缺失的B16细胞对TNFα/IFNγ联合处理表现出明显的敏感性。用不同浓度的TNFα和IFNγ处理B16细胞,归一化生长速率抑制(GR)分析显示,TNFα和IFNγ处理对B16细胞有明显生长抑制,且在TBK1缺失的B16细胞中观察到明显的细胞毒性反应。研究人员发现随着TBK1i浓度升高,TNFα/IFNγ处理的B16细胞活力越低。在TNFα和IFNγ处理组,TBK1i也阻止了B16集落的形成。对抗PD-1耐药性皮肤黑色素瘤和眼部黑色素瘤患者的PDOTS进行评估,结果表明对ICB反应较差的肿瘤通过联合给予TBK1i可使其对外源性TNFα/IFNγ敏感。(见图4)
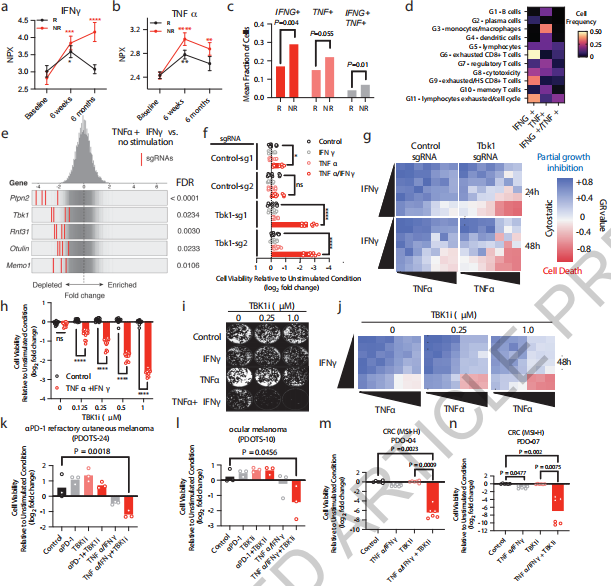
用TNFα/IFNγ处理Tbk1缺失的B16细胞,研究者观察到p-RIPK1水平升高。在TNFα/IFNγ刺激后,Nec1(RIPK1抑制剂)和zDEVD-fmk(caspase 3抑制剂)可以阻止Tbk1缺失的B16细胞中细胞活力的丧失。用TNFα/IFNγ体外刺激对照sgRNA和Tbk1 sgRNA B16细胞,发现在对照细胞和Tbk1缺失细胞中参与IFNγ感应的基因(Ifngr1、Ifgnr2、Jak1、Jak2和Stat1)的sgRNA大量富集。研究者用鲁索利替尼(JAK1/2抑制剂)对Tbk1缺失的B16细胞和TBK1i处理的亲代B16细胞进行预处理,避免了TNFα/IFNγ介导的细胞死亡。鲁索利替尼阻断了细胞的STAT1磷酸化,消除了Tbk1缺失的B16细胞中RIPK1磷酸化、caspase 8裂解和caspase 3裂解。通过GR分析证实,鲁索利替尼将细胞毒反应转化为细胞静息反应,恢复了Tbk1缺失的B16细胞的活力。这些数据表明,Tbk1缺失的B16细胞对TNFα/IFNγ敏感性的增强需要IFN传感,并提供了IFNγ诱导的JAK-STAT信号通路和TNFα介导的RIPK1激活之间的新联系。(见图5)

总的来说,这些发现证实了TBK1作为一种免疫逃避基因的作用,靶向TBK1可以降低效应细胞因子(TNFα/IFNγ)的细胞毒性阈值从而增强对PD-1阻断的反应,揭示了TBK1是一种有效的克服癌症免疫治疗耐药性的新靶点。
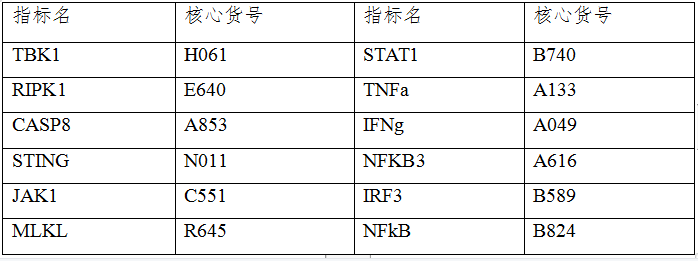
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考。
更多信息,欢迎访问http://www.cloud-clone.com/。