肺癌机制相关研究新发现
肺癌是全球癌症相关死亡的主要原因,其中非小细胞肺癌(NSCLC)是最常见的类型(~85%)。NSCLC细分为肺腺癌(LUAD; ~50%),肺鳞状细胞癌(LUSC; ~30%)和其他(~20%)。尽管在过去十年中对肺癌遗传学的理解、免疫系统在肺癌控制中的作用以及肺癌治疗方案的取得突破性进展,肺癌患者生存率仍然很低,5年生存率在4-17%之间。因此,有必要探索肺癌发生发展的潜在机制,以支持设计新的靶向治疗药物。
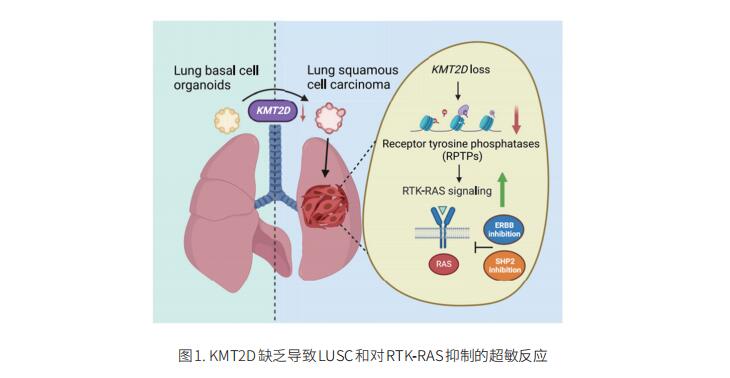
1. KMT2D缺乏导致LUSC和对RTK-RAS抑制的超敏反应
LUSC是肺癌的一种主要亚型,治疗选择有限。KMT2D是LUSC中最常见的突变基因之一,但其在LUSC致癌中的作用尚不清楚。美国纽约大学朗格尼健康中心Kwok-Kin Wong团队确定KMT2D是LUSC肿瘤发生的关键调节因子,KMT2D缺失将肺基底细胞类器官转化为LUSC[1]。KMT2D缺失增加受体酪氨酸激酶(RTK)、EGFR和ERBB2的激活,部分通过重新编程染色质来抑制蛋白酪氨酸磷酸酶的表达。这些事件导致致癌RTK-RAS信号的显著升高(图1)。SHP2抑制剂SHP099和泛ERBB抑制剂阿法替尼联合使用可抑制KMT2D缺陷型LUSC小鼠模型和携带KMT2D突变的患者来源异种移植物中的肺肿瘤生长。这项研究确定KMT2D是LUSC致癌基因的关键表观遗传调节剂,并表明KMT2D缺失使LUSC在治疗上易受RTK-RAS抑制。
2. 多重筛选确定RAS亚型HRAS和NRAS为KRAS驱动的肺癌生长的抑制剂
约30%的LUAD发生癌源性KRAS突变。尽管经过几十年的努力,致癌的KRAS驱动的肺癌仍然难以治疗。通过在原位肺癌模型中的一系列CRISPR/Cas9筛选,斯坦福大学医学院遗传学系Monte M. Winslow团队发现HRAS和NRAS是体内KRASG12D驱动的肿瘤生长的抑制剂,并在致癌的KRAS驱动的人类肺癌细胞系中证实了这些效应[2]。从机制上讲,HRAS和NRAS与致癌KRAS相互作用,减少下游ERK信号传导(图2)。在致癌KRAS驱动的人类肿瘤中发现的HRAS和NRAS突变部分地消除了这一作用。通过比较HRAS和NRAS在致癌KRAS和致癌BRAF驱动的肺癌模型中的肿瘤抑制作用,他们确认HRAS和NRAS是体内KRAS驱动的肺癌的特异性抑制剂。这一研究强调了HRAS和NRAS失衡在致癌KRAS导致的肺癌中的作用。

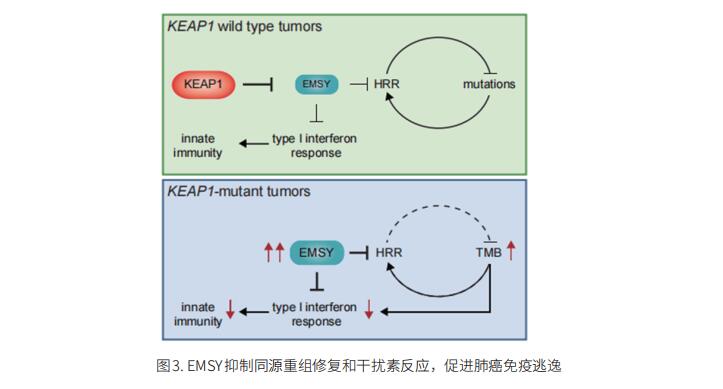
3. EMSY抑制同源重组修复和干扰素反应,促进肺癌免疫逃逸
携带KEAP1突变的NSCLC通常对免疫疗法具有抗药性。纽约大学格罗斯曼医学院生物化学与分子药理学系Michele Pagano团队表明KEAP1靶向EMSY进行泛素介导的降解,以调节同源重组修复(HRR)和抗肿瘤免疫[3]。NSCLC中KEAP1的缺失诱导EMSY的稳定,产生BRCAness表型,即HRR缺陷和对PARP抑制剂的敏感性。此外,EMSY积累抑制I型干扰素反应并损害先天免疫信号传导,促进癌症免疫逃逸(图3)。使用STING激动剂激活肿瘤微环境中的I型干扰素反应导致先天性和适应性免疫信号的参与,并抑制KEAP1突变肿瘤的生长。他们的研究结果表明,单独或联合靶向PARP和STING通路是治疗携带KEAP1突变的NSCLC患者的潜在策略。
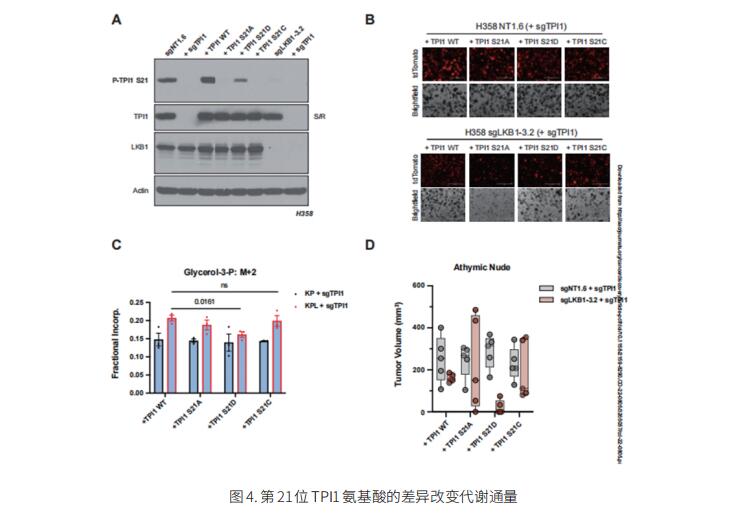
4. LKB1依赖性TPI1调控在人和小鼠LUAD之间产生不同的代谢倾向
KRAS是LUAD中最常见的突变癌基因,激活突变经常与TP53或STK11 / LKB1的功能丧失突变同时发生。然而,在人LUAD中很少观察到所有三个基因的突变,尽管工程共突变在小鼠LUAD中具有高度侵袭性。美国威尔康奈尔医学院医学系桑德拉和爱德华·梅耶癌症中心Benjamin D. Stein团队通过揭示磷酸三糖异构酶(TPI1)调节的进化差异,为这种差异提供了机制解释[4]。在hLUAD中,TPI1活性通过盐诱导激酶(SIK)以LKB1依赖性方式在Ser21处磷酸化调节,调节糖酵解完成和甘油脂质产生之间的通量(图4)。在小鼠中,TPI1的Ser21是一种Cys残基,可以氧化以改变TPI1活性,而无需SIK或LKB1。这些研究结果提示,LKB1或SIK家族蛋白激酶的选择性抑制剂可以有效治疗人类KRAS/TP53突变肺癌或其他具有KRAS/TP53突变的癌症。
参考文献
[1]Pan Y, Han H, Hu H, et al. KMT2D deficiency drives lung squamous cell carcinoma and hypersensitivity to RTK-RAS inhibition [J]. Cancer Cell. 2023;41(1):88-105.e8. (IF=38.585)
[2]Tang R, Shuldiner EG, Kelly M, et al. Multiplexed screens identify RAS paralogues HRAS and NRAS as suppressors of KRAS-driven lung cancer growth [J]. Nat Cell Biol. 2023;25(1):159-169. (IF=28.213)
[3]Marzio A, Kurz E, Sahni JM, et al. EMSY inhibits homologous recombination repair and the interferon response, promoting lung cancer immune evasion [J]. Cell. 2022;185(1):169-183.e19. (IF=66.850)
[4]Stein BD, Ferrarone JR, Gardner EE, et al. LKB1-dependent regulation of TPI1 creates a divergent metabolic liability between human and mouse lung adenocarcinoma [J]. Cancer Discov. 2023;CD-22-0805. (IF=38.272)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究;还具有各类癌症检测指标及上述EGFR、ERBB2、HRAS、NRAS、KRAS、BRAF、TPI1、SIK和LKB1等相关产品,可助力广大科研工作者进行癌症相关研究。