云克隆可提供转基因鼠繁殖以及乳鼠相关实验服务
云克隆不仅可以开展正常周龄大、小鼠的相关实验,还可进行以胎鼠、乳鼠、新生鼠为实验对象的相关实验,以及转基因小鼠和基因敲除小鼠的繁殖,种群扩大工作。
案例展示:
I. 先天性巨结肠相关性小肠结肠炎的动物模型
先天性巨结肠相关性小肠结肠炎(HAEC)是先天性巨结肠的常见并发症,是导致巨结肠患儿死亡的常见原因,发病率为5%~42%。
为了建立先天性巨结肠相关性小肠结肠炎的动物模型, 由于采用了Ednrb-/-的基因敲除的鼠,杂合子和野生型鼠均为灰色,纯合子就表现棕白色相间的花斑鼠(如图1所示)。Ednrb-/-纯合子小鼠由于末端结肠缺乏肠神经节细胞分布,在出生后出现严重的便秘及反复发作的HAEC,如不进行干预一般在出生后3-4周死亡,是目前最常用的HSCR及HAEC动物模型之一。

图1.繁殖的 Ednrb-/-纯合子小鼠(花斑鼠)与杂合子小鼠对比图
云克隆动物中心进行了Ednrb-/-转基因鼠的交配、繁殖和鉴定工作,图1中的鼠即为我们生产动物房所繁殖的转基因鼠,并在转基因鼠上进行了一系列细胞治疗先天性巨结肠病的研究。
II. 坏死性小肠结肠炎(NEC)大鼠模型
坏死性小肠结肠炎(NEC)是早产儿、低出生体重儿最常见急腹症之一。该病的起病症状不典型,病情进展快,死亡率高。目前国内的NEC病死率约为10%~50%。因此,建立该疾病的动物模型很有必要。
云克隆采用体重约5~10g的新生SD大鼠,在其出生48h内母乳喂养,自由摄食,与母鼠同笼;出生后48h随机分成模型组和对照组。对照组新生大鼠出生48h后继续与母鼠同笼,鼠乳喂养,不进行缺氧冷刺激。模型组新生大鼠出生48h后与母鼠分开,置入保育箱中并采用鼠乳代用品人工喂养,并定期给与缺氧冷刺激,以建立新生鼠坏死性小肠结肠炎动物模型;具体建模方法如下:
1. 新生大鼠与母鼠分离,放置在保育箱内(控制保育箱内温度28~30℃,湿度45%~65%),采用鼠乳代用品喂养。采用5号静脉留置针定时经口插管喂养,第1天给予0.2ml/次,每4小时1次,随后每24h增加0.2ml/次,48h后逐渐增至0.4ml。
2. 缺氧及冷刺激:将新生SD大鼠置入缺氧箱中,5%氧气+95%氮气 10分钟,随即打开缺氧箱,取出新生鼠,随后将其置入冰箱冷藏室中,给予4℃刺激,持续10分钟,结束后放回保育箱。每日2次,分别进行一次缺氧+冷刺激,连续3d,最后一次缺氧+冷刺激后24h空腹断头处死大鼠,打开腹腔取出十二指肠下端至直肠上端的肠道组织。结果发现,与对照组新生大鼠相比,NEC组新生大鼠明显体型偏小(如图2所示):
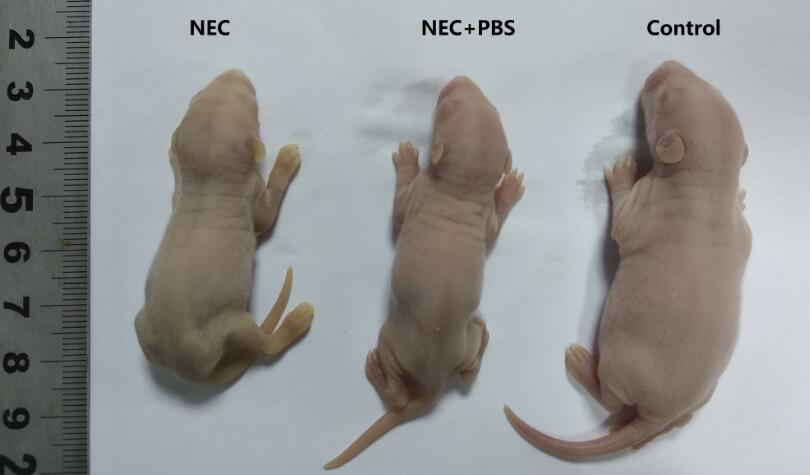
图2. NEC模型乳鼠及其对照的对比图
III. 新生鼠脑白质损伤
新生儿脑白质损伤是一组具有多种病理类型的疾病,其病理特点主要包括反应性星形胶质化、髓鞘损害和轴突病变等,这些病变被认为是脑瘫发生的最重要的危险因素。缺氧缺血或宫内感染等最终导致脑白质组织的坏死、星形胶质化、细胞凋亡以及囊腔形成等多种病理改变。
云克隆建立了新生儿脑白质损伤的大鼠模型,具体方法如下:
将若干SD大鼠按照雌雄比=1:2进行交配合笼,待其生下子代后,将6日龄乳鼠挑出,随机分成模型组和对照组。模型组操作如下:
1)出生后6天的大鼠在冰上间接冷却至对伤害性刺激无反应时进行深度麻醉;
2)用酒精清洁皮肤,在前颈部位做腹正中切后,在解剖显微镜下,通过轻轻收缩肩胛舌骨和胸锁乳突肌的肌肉来接近右颈总动脉分叉点;
4)颈动脉鞘周围筋膜被切除,从附近的走神经和交感神经处用钩子分离近端内支,将颈内动脉结扎;
5)结扎后,缝合皮肤切口,保持体温(28℃及以上)直到完全清醒,然后放回大鼠;
6)颈部结扎1小时后,将动物置于充满氮气的密封箱(37℃),灌输6%的氧气,缺氧缺血感染组在缺氧环境中暴露80 min;
7)缺氧缺血感染组动物放在电热垫子上恢复30分钟后,腹腔注射 (0.3 mg/kg) 的脂多糖;
8)以颈动脉暴露,但是没有结扎、无缺氧暴露、无LPS注射的大鼠为对照组。
武汉云克隆动物有限公司(CCA)为云克隆科技股份有限公司(CCC)的全资子公司,其位于振华路33号的SPF繁殖动物房面积220平方米,具有《实验动物生产许可证》。


具有动物繁殖资质的屏障环境的动物房,为云克隆进行种群扩大,实验动物的繁殖,孕鼠和孕鼠的相关的实验研究及服务提供了有利的保障。