RhoJ GTPases参与整合内皮细胞定向迁移的信号
 2020年4月29日,来自神户大学医学研究院和名古屋城市大学医学院的Akiyoshi Uemura教授发表题为“RhoJ integrates attractive and repulsive cues in directional migration of endothelial cells.”的文章。研究表明内皮细胞(Endothelial cells, ECs)中RhoJ的缺失能有效抑制视网膜中异常血管的形成。不同的RhoJ GTPases可能在细胞定向迁移中作为环境依赖的趋化线索整合物发挥功能,并且可能作为控制疾病或组织再生中细胞活性的候选靶点。
2020年4月29日,来自神户大学医学研究院和名古屋城市大学医学院的Akiyoshi Uemura教授发表题为“RhoJ integrates attractive and repulsive cues in directional migration of endothelial cells.”的文章。研究表明内皮细胞(Endothelial cells, ECs)中RhoJ的缺失能有效抑制视网膜中异常血管的形成。不同的RhoJ GTPases可能在细胞定向迁移中作为环境依赖的趋化线索整合物发挥功能,并且可能作为控制疾病或组织再生中细胞活性的候选靶点。
在这篇文章中,云克隆ELISA试剂盒(信号素3E(Semaphorin 3E, Sema3E)ELISA Kits,SEL920Mu)再次受到了科研工作者们的认可。

信号素3E ELISA Kit
货号:SEL920Mu
实验方法:双抗夹心
检测范围:0.156-10ng/mL
研究介绍:
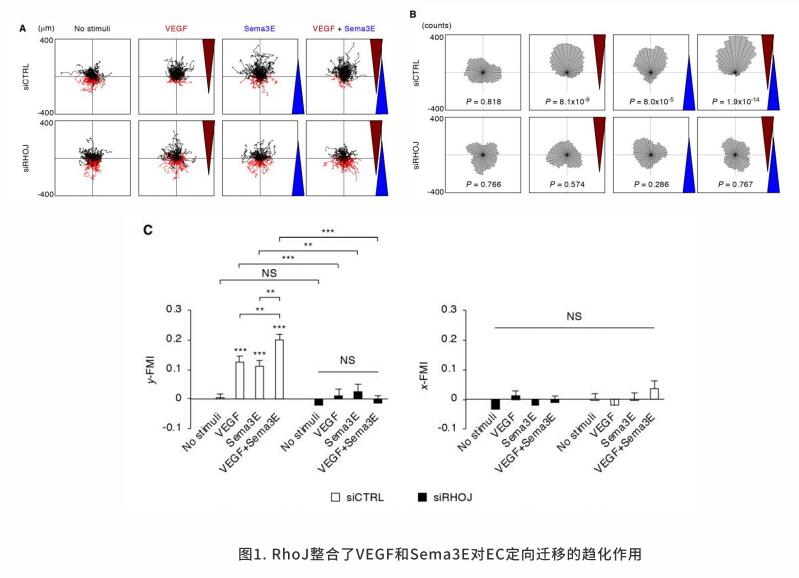
在器官发育过程中,组织细胞的定向迁移在很大程度上取决于吸引和排斥信号以及细胞表面受体的协同控制。这些趋化信号也参与了各种疾病的发生和发展。血管形成过程中,ECs在正在生长的血管中前后移动,改变各自的位置。当细胞到达血管前端时,细胞骨架和细胞基质会根据微环境进行动态调整,从而决定新生血管的萌发方向。
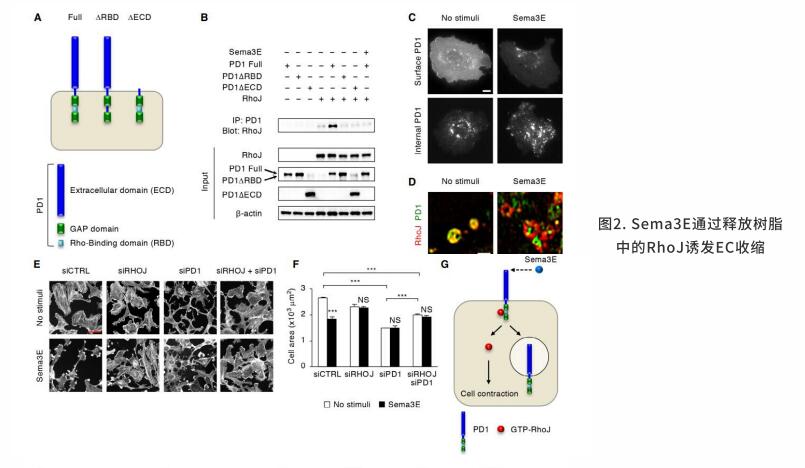
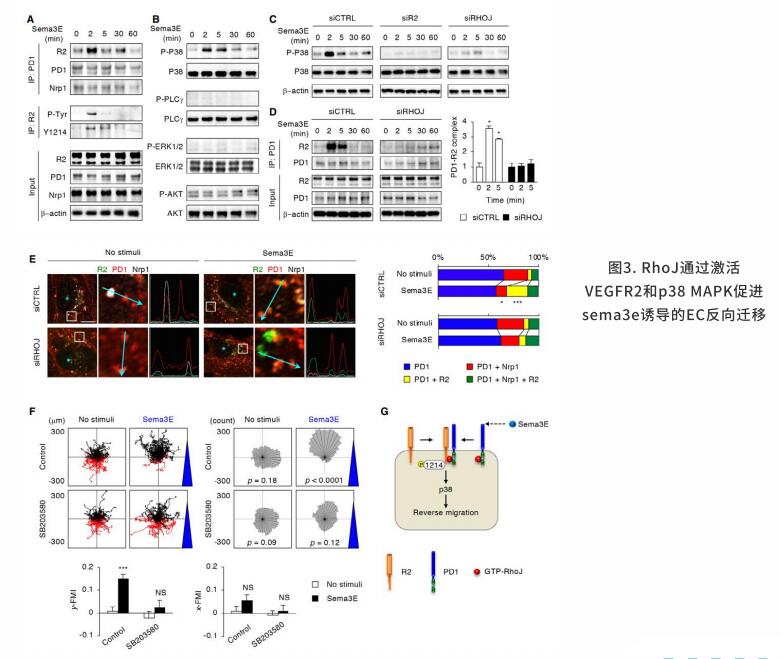
血管内皮生长因子A(Vascular endothelial growth factor A, VEGFA)是迁移的内皮细胞的主要趋化诱导剂。VEGFA与酪氨酸激酶VEGF受体2 (VEGF receptor 2, VEGFR2)结合,诱导其在Y1175和Y1124等多个酪氨酸残基上的自磷酸化,从而激活一系列细胞内信号级联。磷脂酶Cγ(Phospholipase C gamma, PLCγ),胞外信号调节激酶(Extracellular signal-regulated kinase, Erk),Akt通路的完全激活需要经过VEGFR2内化后在Y1175位点磷酸化。这些来自细胞内的信号随后被VEGFR2的降解终止。信号素3E(Semaphorin 3E, Sema3E)与跨膜受体PlexinD1结合通过诱导PlexinD1内化,肌动蛋白解聚化和粘着斑激酶分解来调控ECs中的排斥信号。为了响应不同的外部信号,Rho家族的小G蛋白作为分子开关,通过在GTP和GTP结合状态之间循环,控制不同类型细胞的迁移。
研究发现小G蛋白RhoJ可以在ECs中定向迁移,整合反向信号。在GTP结合状态下,RhoJ与PlexinD1的胞质结构域互作。在Sema3E的刺激下,从PlexinD1中释放的RhoJ可以诱导细胞收缩。PlexinD1与RhoJ的结合促进Sema3E诱导PlexinD1-VEGFR2相结合,之后VEGFR2在Y1214和p38 MAPK激酶处发生磷酸转移作用致使EC反向迁移。在VEGF刺激下,RhoJ需要形成全息受体复合物,包括VEGFR2、PlexinD1和neuropilin-1,从而防止内化的VEGFR2降解,通过PLCγ,、Erk和Akt延长下游信号转导,并促进EC向前迁移。在转化到GDP结合状态后,RhoJ由PlexinD1转换到VEGFR2,致使VEGFR2信号终止。