hRNase 1–EphA4诱导乳腺癌的发生

文献导读
2021年5月13日,来自美国德州大学安德森癌症中心的Mien-chie Hung和Dihua Yu教授在《Nature Communications》上联合发表了题为“Human ribonuclease 1 serves as a secretory ligand of ephrin A4 receptor and induces breast tumor initiation”的文章。

研究介绍
人核糖核酸酶1(hRnase1)是清除细胞外RNA的关键酶,可以维持体内稳态以及宿主防御。虽然hRnase1的生化成分和转录后修饰等过程已经有所了解,但是对其生物学功能的研究还不够透彻,尤其是癌症方面。近来研究发现,Rnase和受体酪氨酸激酶(RTKs)在胰腺癌和肝癌中存在新的配体-受体关系。作者研究发现hRNase 1–EphA4这对新的配体-受体对在乳腺癌的发生中起着重要作用。
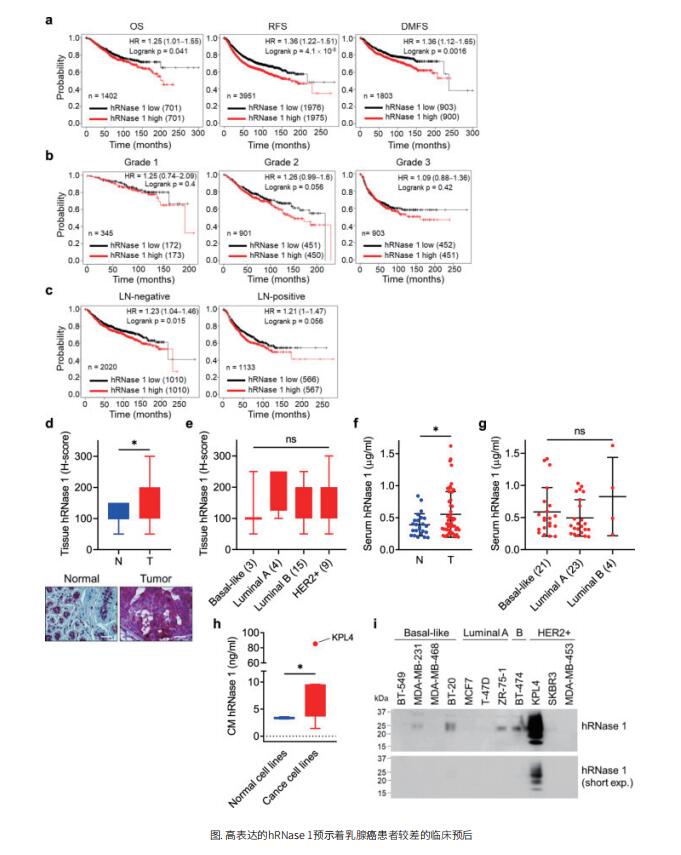
首先,为了系统地识别hRnase超家族成员对于癌症发展的作用,作者使用Kaplan-Meier Plotter数据库对患者进行分层分析。结果显示,只有hRnase1与乳腺癌患者生存期呈显著负相关。此外,在2级肿瘤中,较高的hRNase 1表达与较差的生存状况显著相关。与淋巴结阳性转移患者相比,在淋巴结阴性非转移乳腺癌患者中,hRNase 1似乎是更显著的不良预后因素。在乳腺癌的四种分子亚型中,hRNase 1和管腔A、管腔B亚型乳腺癌患者的生存率呈负相关。为了进一步研究hRNase1在乳腺癌中的作用,作者使用乳腺肿瘤组织芯片(breast tumor tissue microarray, TMA)检测肿瘤组织,发现hRNase1在乳腺肿瘤(T)中的平均表达水平明显高于正常乳腺组织(N),血清中的表达水平同样如此。这些结果表明,乳腺癌患者组织和血清中hRNase1水平高于正常个体。
作者在MCF7管腔A乳腺癌细胞中表达hRNase1,发现hRNase1显著增加了原代、继代和三代中球体形成的数量。此外,hRNase1在MCF7母代细胞中富集了CD24−/CD44+细胞,这是乳腺CSC样细胞的分子特征。进一步地,作者发现hRNase1不依赖于核糖核裂变活性的功能就可以丰富乳腺CSC样细胞的数量,提高肿瘤产生能力。沉默hRNase 1可以减少乳腺CSC样细胞的数量,并降低肿瘤产生能力。
基于上述结论,作者开始探讨hRNase1的分泌机制及其对肿瘤细胞的生物学影响。作者使用重组hRNase1蛋白进行处理增加了海拉细胞中的EphA4、HGFR和Tie-2的酪氨酸磷酸化以及BT-549细胞中EphA4、EphA10和ROR2酪氨酸磷酸化。于是,作者开始关注hRNase1是否能影响EphA4通路。结果表明,hRNase1直接与EphA4结合,作为配体诱导EphA4下游信号转导。之后,作者发现,hRNase1与EphA4之间的相互作用是通过hRNase1的C端相结合并且需要EphA4的配体结合域帮助。
接下来,作者对hRNase1和EphA4之间的配体-受体关系特征进行了进一步的研究,并将只与经典的膜相关ephrin配体进行比较。首先,作者证明了hRNase 1诱导EphA4二聚/齐聚。之后,作者发现hRNase1直接特异性介导EphA4激活,而不是通过增加经典ephrin配体的表达水平来间接影响。有研究表明EphA4下游信号分子,如NF-κB、Erk、Src和Akt,在不同类型的细胞中被活化以响应ephrin-EphA 近泌性信号。基于此,作者发现在表达hRNase1的BT-549细胞中,NF-κB活化程度明显高于对照组。hRNase1通过IKK/NF-κB和MEK/Erk激活通路诱导球状体形成。EphA4正向调控hRNase 1介导的乳腺肿瘤起始和肿瘤发生。并且,hRNase 1水平、EphA4活化和干细胞样细胞群之间的正相关支持了hRNase 1 - EphA4轴在肿瘤起始过程中的病理相关性,这对乳腺癌治疗具有潜在的临床意义。
乳腺癌检测标志物
乳腺癌属于女性高发癌症,发病率位居各类癌症前列,乳腺癌发病高峰为45~60岁,近年呈现年轻化的趋势。随着乳腺癌预后研究的深入,越来越多的预后标志物被人们发现,部分已经应用于临床作为乳腺癌分子分型的依据,如雌激素受体(ER)、孕激素受体(PR)和原癌基因Her2均为阴性的三阴性乳腺癌标志物,往往提示患者预后较差。现根据生物标志物进行分子分型的乳腺癌有十几种,这些标志物可以检测乳腺癌的发生或者复发。云克隆提供多个膀胱癌检测标志物的蛋白、抗体以及ELISA试剂盒产品,广泛的应用于人、小鼠、大鼠、猪、羊等多个物种的检测。