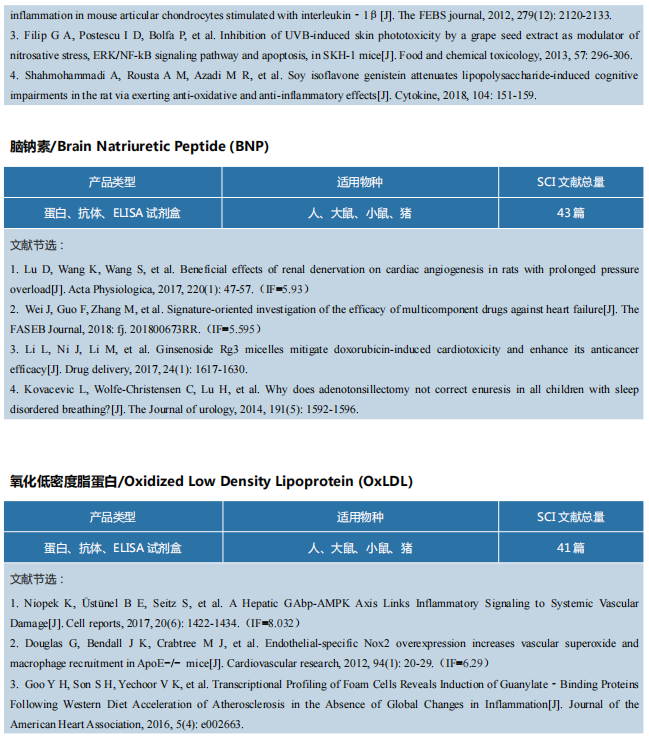
C5a/C5aR1轴控制组织新生血管形成的机制

文献导读
2021年6月7日,来自德国吕贝克大学心脏中心的Harald F. Langer教授及其团队在国际期刊《Nature communications》上发表了题为“The C5a/C5a receptor 1 axis controls tissue neovascularization through CXCL4 release from platelets”的文章。

研究介绍
组织稳态和愈合在生物体中是至关重要的。补体系统,先天免疫反应的中心角色,有助于组织稳态和功能障碍。最近的临床试验表明,补体系统可能是在不同病理条件下(如中风、哮喘和心肌梗死)恢复组织功能的治疗靶点。补体系统包含了30多种血浆和细胞结合蛋白,作为先天免疫防御的重要哨兵发挥作用。此前,补体级联成分已被证明在不同的病理生理环境中调节血管生成,然而,补体系统干预促血管生成或抗血管生成细胞或受体的确切机制仍有待确定。
血小板在以血栓形成为特征的疾病中起着决定性的作用,因此靶向血小板相关功能是治疗这些疾病的治疗原则。除了经典的止血功能外,血小板还参与炎症、免疫调节和动脉粥样硬化。最近发现,在血小板上表达的补体C3a受体可调节血小板聚集。有趣的是,血小板将促血管生成和抗血管生成因子储存在不同的颗粒中,并在刺激下释放它们。但是血小板在体内调节血管生成的机制并不清楚。
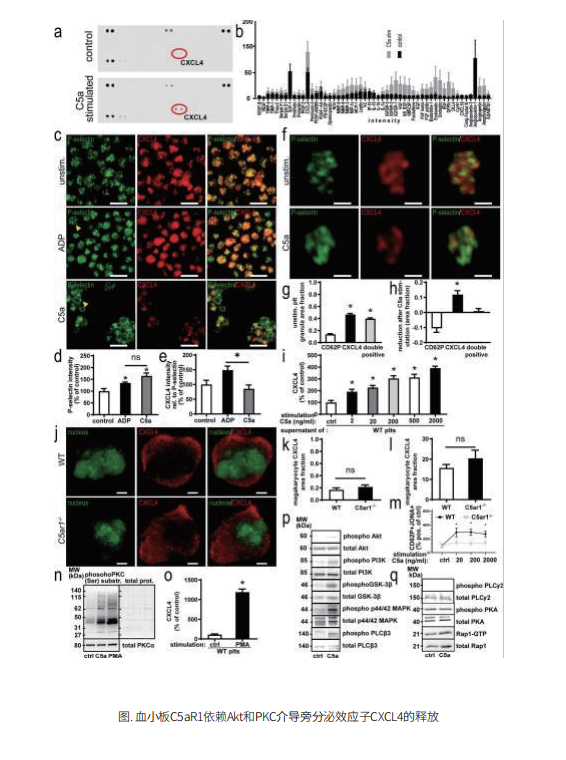
作者为了阐明血小板在体内血管形成和补体激活中的作用,进行了后肢缺血实验。作者发现当内皮细胞缺氧时,血小板可以在血管表达补体过敏毒素受体C5aR1。而C5a介导的血小板的C5aR1的激活则抑制了对于血管形成十分重要的内皮细胞静态黏附、增殖、内皮管形成等功能。之后,作者利用小鼠胚胎血管生成和后肢缺血诱导的血管重建,探究C5aR1在血管形成中的功能。发现敲除C5aR1基因的小鼠通过缺血诱导血运重建增加,这表明C5aR1激活在血小板缺血诱导的血管生成中起着关键作用。血小板C5aR1对内皮细胞功能的抑制与体外血管生成相关。血小板通过C5aR1调节血管生成相关的特定内皮功能。血小板C5aR1介导缺血诱导血管重建中侧支动脉形成的抑制作用,毛细血管形成和周细胞覆盖。之后,作者发现受到C5a刺激时血小板释放CXCL4。在体内和体外,血小板C5aR1介导的血管形成效应是通过优先释放CXCL4介导的。
作者观察到血管再生组织中血小板的存在增加,检测到血管再生组织中血小板上的过敏毒素受体C5aR1。通过血小板重建和药物抑制的方法证明了血小板C5aR1在体外内皮功能和体内新生血管形成中的重要性。此外,作者建立了血小板特异性C5aR1缺陷小鼠模型,用来特异性评估血小板C5aR1介导的效应。血小板源趋化因子CXCL4在体内是血管形成的抑制剂,在体外是内皮功能的抑制剂。C5a/C5aR1轴不仅是血小板活化的有效诱导剂,而且能驱动CXCL4的释放。作者发现靶向CXCL4足以阻断血小板C5aR1对血管形成的影响。这些发现表明,C5aR1传递的作用可以在药理上被阻断,CXCL4是C5a刺激血小板后释放的主要血管生成因子。
总之,作者发现了一种通过血小板中C5a/C5aR1轴激活以及随后诱导抗血管生成因子CXCL4来控制组织新生血管形成的机制。这强调了血小板和补体系统在血管形成中的作用,并确定了C5aR1-CXCL4轴是这三个系统之间的交叉点。