TIM-3通过调节炎症小体激活来抑制抗肿瘤免疫
随着针对免疫检查点的抗体和表达嵌合抗原受体的T细胞疗法的飞速发展,使得免疫治疗成为高度关注的新兴热点。TIM-3是继PD-1/PD-L1、CTLA-4之后,又一个新兴的免疫检查点分子。
T细胞免疫球蛋白黏蛋白分子3(TIM-3)是一种在能产生干扰素-γ的CD4+和CD8+T细胞上表达的受体,但是在许多其他类型的细胞中也发现了TIM-3的表达,包括调节性(Treg)T细胞、髓细胞、自然杀伤细胞和肥大细胞。尽管已经有多个针对TIM-3的阻断性单克隆抗体进入临床试验,但是这些抗体抗肿瘤活性的确切机制还不清楚。
2021年6月9日,来自哈佛医学院的Vijay K. Kuchroo研究组在《nature》期刊发表重要研究成果,揭示了TIM-3在调节树突状细胞(DCs)功能中的重要作用,并强调了TIM-3阻断剂通过调节质体活化促进抗肿瘤免疫的潜力。

为了阐明TIM-3在T细胞中的特定功能,研究人员同时敲除CD4+和CD8+ T细胞中的TIM-3(基因名为Havcr2)后,肿瘤生长得到一定的抑制,但不是非常显著;而特异性敲除CD8+ T细胞、调节性T细胞或自然杀伤(NK)细胞中的TIM-3,均不影响肿瘤的生长。根据这些结果,研究人员设想,TIM-3在调节抗肿瘤免疫中的作用可能主要通过髓细胞尤其是DCs介导。
为了进一步研究,他们对肿瘤浸润性CD45+细胞(肿瘤浸润性淋巴细胞(TILs))进行了单细胞RNA测序分析(scRNA-seq);利用流式细胞术,分析来自MC38卵磷脂的CD45+白细胞,发现肿瘤中DC1s和迁移型DCs(migDCs)的TIM-3高度表达。在特异性敲除DCs中的TIM-3后,观察到肿瘤生长显著减少。研究人员平行比较了树突状细胞和T细胞上TIM-3的缺失,发现树突状细胞群中TIM-3的缺失导致对肿瘤生长的显著抑制。他们评估了肿瘤内DC1和migDCs上细胞因子、趋化因子、共抑制和共刺激分子的表达,但未发现实质性变化。这些结果表明TIM-3通过调节DC功能来促进抗肿瘤免疫中起主导作用。
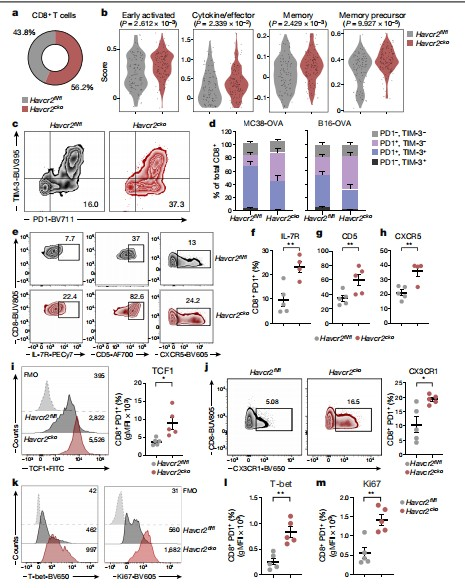
图1 scRNA-seq数据和流式细胞术分析结果
研究人员使用三种不同的方法来抑制炎症小体途径:(1)一种干扰前IL-1β和前IL-18裂解的半胱天冬酶1抑制剂;(2)MCC950干扰炎症小体复合蛋白ASC40的寡聚化;(3)抗IL-1β和抗IL-18阻断抗体(抗IL-1β/IL-18)抑制下游效应细胞因子。这些方法中的每一种都消除了Havcr2cko中的保护性抗肿瘤免疫,其中抗IL-1β/IL-18具有最有效的作用。结果发现敲除TIM-3所增强的抗肿瘤作用完全消失,CD8+ T细胞的功能增强效果也被消除。
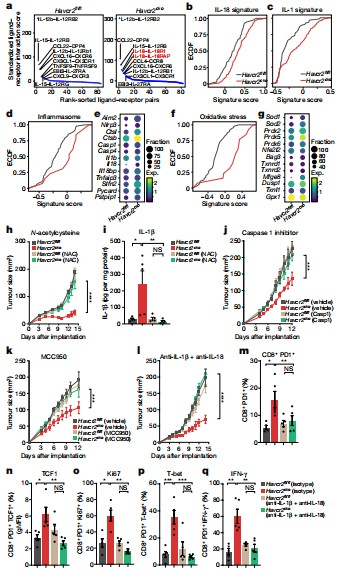
图2 DCs上TIM-3的缺失促进炎症小体激活。
TIM-3已被确定为AML中白血病干细胞的标志物,在难治性AML患者中尤其高表达,因此,TIM-3已成为一个有吸引力的治疗靶点。新的数据已经表明,TIM-3阻断治疗急性髓细胞白血病和骨髓增生异常综合征可诱导50–60%的应答率,因此,将 TIM-3 阻断作为治疗其他检查点抑制剂成功率有限的髓系肿瘤是一种较好的治疗策略。总的来说,这些研究结果揭示了TIM-3在调节DC功能中的重要作用,并强调了TIM-3阻断在释放炎症小体活性以增强抗肿瘤免疫方面的价值。
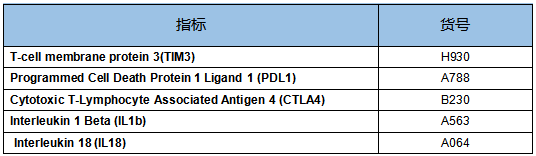
云克隆为广大研究者提供相关产品,相关检测指标如下: