肿瘤细胞耐药机制新发现
常规化疗和靶向治疗构成了癌症管理一线治疗的重要组成部分。大多数早期肿瘤患者在化疗和靶向治疗后获得完全或部分缓解,而晚期肿瘤患者的治疗结果往往不佳。肿瘤细胞通过多因素内在和获得性耐药机制逃避化疗和靶向治疗的细胞毒性,而耐药性是化疗失败的主要原因。
肿瘤细胞耐药机制研究
耐药性的发展是癌症治疗的一个主要挑战。癌症治疗过程中的适应性变化促进了多种机制的耐药,包括抗癌药物靶点的改变、平行旁路信号通路的激活、肿瘤微环境的改变,DNA损伤修复、上皮细胞向间质转化(EMT)的发生和细胞药理学的改变等。对这些耐药机制的研究可能成为耐药癌症的治疗靶点,有助于改善癌症耐药结果。
1. FGFR抑制剂介导SWI/SNF复合物与YAP依赖的增强子分离诱导适应性治疗耐药性
成纤维细胞生长因子受体(FGFR)抑制剂治疗三阴性乳腺癌 (TNBC) 可有效阻断肿瘤细胞增殖。然而,适应性或内在耐药性是限制治疗效果的常见问题。哈佛医学院丹娜法伯癌症研究所Myles Brown团队报告了导致TNBC对FGFR抑制剂的适应性耐药的表观遗传机制[1]。他们确定 mTOR 和 YAP 损失是 FGFR 抑制的致敏剂,而 ARID1A 或 BRG1 耗竭会产生耐药性。FGFR抑制剂通过抑制 SWI/SNF 调节的表观遗传状态,导致 YAP 依赖性增强子的重新激活,进而促进由 mTORC1 途径感知的氨基酸转运,导致癌症细胞对FGFR抑制剂适应性耐药(图1)。这种 FGFR 抑制剂激活的反馈回路限制了抑制剂的功效,可以通过 mTORC1 抑制逆转,为确定治疗 FGFR 异常 TNBC 的有效治疗策略提供帮助。
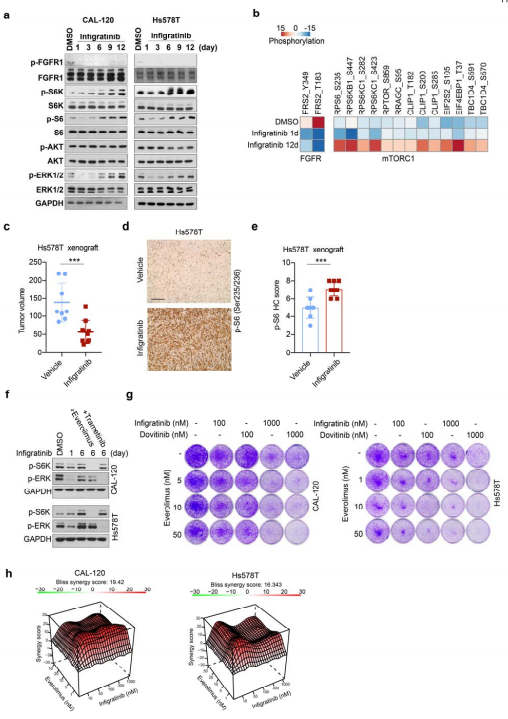
图1 mTORC1信号的重新激活是对FGFR抑制剂的适应性耐药必要条件
2. 癌细胞衍生的外泌体 circUSP7 通过调节 NSCLC 中的 miR-934/SHP2 轴诱导 CD8+ T 细胞功能障碍和抗 PD1 抗性
近年来,越来越多的研究报道外泌体在体内发挥着重要的生物学功能,尤其是在肿瘤的发生发展和circRNAs方面。南昌大学第二附属医院 Yong-Bing Wu团队发现非小细胞肺癌(NSCLC) 细胞以外泌体方式分泌circUSP7,并且 circUSP7 抑制 CD8+ T 细胞分泌的 IFN-γ、TNF-α、颗粒酶-B 和穿孔素[2]。此外,circUSP7 通过海绵 miR-934 上调含有 Src 同源区 2 (SH2) 的蛋白酪氨酸磷酸酶 2 (SHP2) 的表达来抑制 CD8+ T 细胞功能。同时,circUSP7 可能会促进 NSCLC 患者对抗 PD1 免疫疗法的耐药(图2)。

图2 CircUSP7以CD8+ T细胞依赖的方式促进非小细胞肺癌的进展,并导致抗pd1治疗的耐药性
3. 抑制USP28通过抑制范可尼贫血途径克服鳞状肿瘤的顺铂耐药性
鳞状细胞癌 (SCC) 通常具有异常高的突变负荷。因此,它们会迅速对铂类化疗产生耐药性。ΔNp63 能够调节 DNA 损伤反应基因的表达,因此 ΔNp63 有助于 SCC 对基于铂的化疗的抗性。维尔茨堡大学生物化学和分子生物学系Markus E. Diefenbacher团队报告USP28 通过 ΔNp63 在顺铂化疗期间维持 SCC 的基因组完整性,并且靶向 USP28 使 ΔNp63 阳性 SCC 对化疗敏感[3]。USP28-ΔNp63 轴增强范可尼贫血基因的表达,从而有助于重组 DNA 修复和顺铂抗性(图3)。靶向 SCC 中的 USP28-ΔNp63 轴会减弱这种 DNA 损伤反应途径,从而使 SCC 细胞对顺铂治疗敏感。

图3 抑制USP28活性可解除体内范可尼贫血--DNA损伤修复信号通路,使肿瘤细胞对顺铂敏感
4. Q61H 突变使 KRAS 与上游调控脱钩,并使癌细胞对 SHP2 抑制剂产生耐药性
携带不同 KRAS 突变的癌细胞对 SHP2 抑制剂 (SHP2i) 表现出不同的敏感性。加拿大玛格丽特公主癌症中心Mitsuhiko Ikura团队发现携带 KRAS Q61H 的细胞对 SHP2i 具有独特的抗性,并使用生物物理学、分子动力学和基于细胞的方法研究了潜在机制[4]。Q61H 突变会损害GAP 介导的 GTP 水解,并阻碍 SOS1 的激活。SHP2 可以通过调节 GEF/GAP 活性和使 KRAS 去磷酸化来刺激 KRAS 信号传导。与 SHP2i 敏感性相关的野生型和 KRAS Gly12 突变型的磷酸化赋予对 GAP 和 GEF 活动调节的抗性并削弱与 RAF 的结合,而 KRAS Q61H突变型的近乎完全保持 GAP/GEF 结合,并且保留与RAF 高亲和力相互作用能力(图4),使SHP2i无法调节 Q61H 突变体的信号传导而耐药。

图4 KRAS Q61H耐酪氨酸磷酸化调控RAF-RBD结合
参考文献
[1]Li Y, Qiu X, Wang X, et al. FGFR-inhibitor-mediated dismissal of SWI/SNF complexes from YAP-dependent enhancers induces adaptive therapeutic resistance [J]. Nat Cell Biol. 2021, 23(11):1187-1198. (IF=28.824)
[2]Chen SW, Zhu SQ, Pei X, et al. Cancer cell-derived exosomal circUSP7 induces CD8+ T cell dysfunction and anti-PD1 resistance by regulating the miR-934/SHP2 axis in NSCLC [J]. Mol Cancer. 2021, 20(1):144. (IF=27.401)
[3]Prieto-Garcia C, Hartmann O, Reissland M, et al. Inhibition of USP28 overcomes Cisplatin-resistance of squamous tumors by suppression of the Fanconi anemia pathway [J]. Cell Death Differ. 2021;10.1038/s41418-021-00875-z. (IF=15.828)
[4]Gebregiworgis T, Kano Y, St-Germain J, et al. The Q61H mutation decouples KRAS from upstream regulation and renders cancer cells resistant to SHP2 inhibitors [J]. Nat Commun. 2021;12(1):6274. (IF=14.919)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标相关产品,可助力广大科研工作者进行癌症耐药相关研究。


