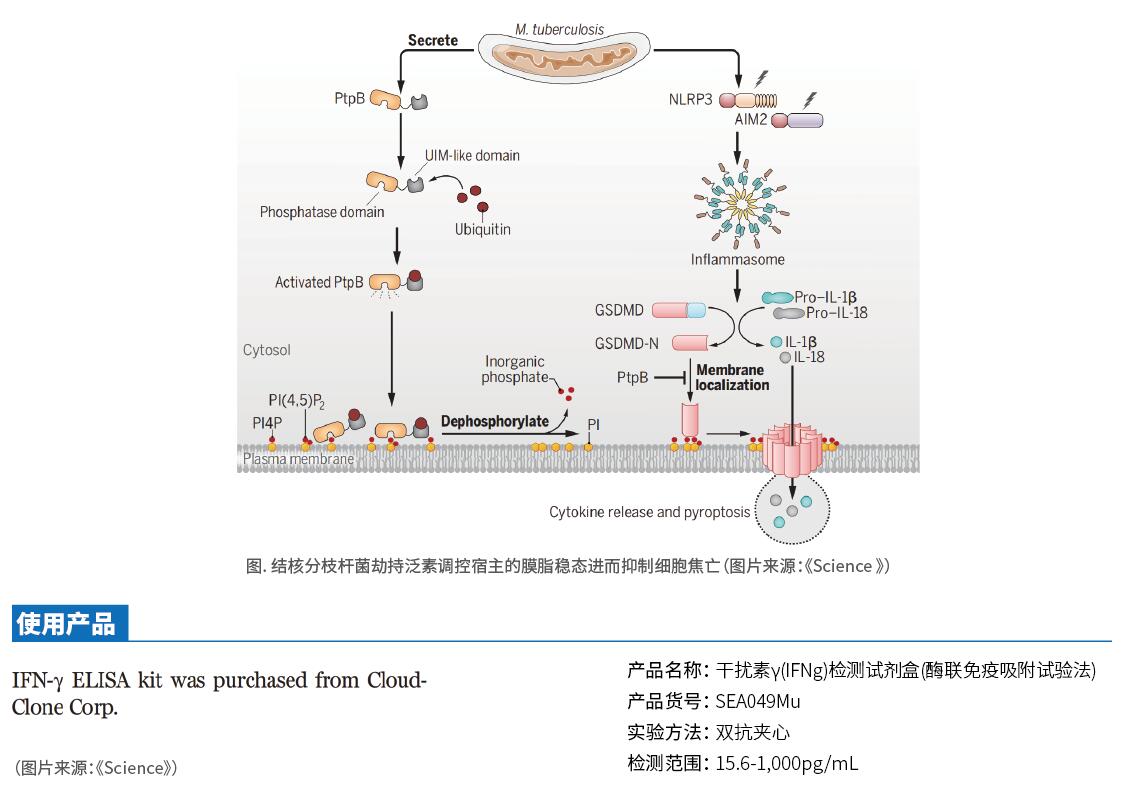
Science:结核分枝杆菌脂磷酸酶劫持宿主泛素抑制细胞焦亡
2022年10月14日,来自中国科学院微生物研究所刘翠华等研究人员合作在《科学》杂志发表了标题为“A bacterial phospholipid phosphatase inhibits host pyroptosis by hijacking ubiquitin.”的研究成果,发现一种细菌性磷脂磷酸酶通过劫持泛素抑制宿主的焦亡。

炎症小体(inflammasome)是近年来在哺乳动物免疫细胞中发现的一种多聚蛋白复合物,主要由胞质中的模式识别受体(如NLRP3和AIM2等)、凋亡相关斑点样蛋白(ASC)及caspase-1前体蛋白(pro-caspase-1)组成。已有研究提示,炎症小体—细胞焦亡通路在宿主抵抗Mtb等病原体感染过程中发挥重要作用。然而,这些病原体是否能够以及如何逃逸该免疫机制尚不清楚。
在本项研究中,研究人员通过在HEK293T细胞中构建AIM2和NLRP3炎症小体的重组系统对Mtb编码的真核样分泌蛋白进行全面筛选,鉴定出Mtb分泌的蛋白磷酸酶PtpB是宿主炎症小体—细胞焦亡通路的潜在抑制分子。进一步的研究表明,PtpB在Mtb感染时可定位至宿主细胞质膜并依赖其磷酸酶活性去磷酸化质膜上的磷脂酰肌醇-4-单磷酸(PI4P)及磷脂酰肌醇-(4,5)-二磷酸(PI(4,5)P2),从而抑制GSDMD-N在质膜上的聚集并阻止细胞焦亡及细胞因子IL-1β和IL-18的释放。PtpB虽然在细胞内具有显著的去磷酸化PI4P及PI(4,5)P2的功能,但其在细胞外仅表现出有限的脂磷酸酶活性。结构生物学分析表明PtpB的酶活中心(P-loop)被掩盖在一个盖状的柔性双螺旋结构(lid)内,提示其磷酸酶活性可能受到动态调控。进一步的深入探寻证实了PtpB依赖一个特殊的真核样泛素结合模序(UIM-like)通过疏水相互作用结合宿主泛素并被其激活进而去磷酸化PI4P和PI(4,5)P2,导致这两种分子在宿主细胞质膜上的丰度显著减少进而抑制GSDMD-N在质膜上的聚集及细胞焦亡的发生。随后的小鼠感染实验证明,破坏PtpB的脂磷酸酶活性或泛素结合区域可以显著增强宿主在感染早期依赖GSDMD的保护性免疫反应及清除Mtb的能力,并减轻宿主在感染晚期的病理性免疫损伤。因此,病原体通过改变宿主的膜组成来抑制焦亡作用并抵消宿主的免疫力。