细胞死亡与癌症(三)——Parthanatos与癌症的关联
在之前的专题中,介绍了细胞坏死、细胞凋亡、坏死性凋亡、细胞焦亡及铁死亡与癌症的关联。本期专题,我们将介绍多聚ADP-核糖聚合酶1(PARP-1)介导的细胞死亡与癌症的关联。
PARP-1介导的细胞死亡(Parthanatos)
Parthanatos是一种依赖PARP-1的新型调节性细胞死亡方式。ROS、紫外线照射、烷化裂等可导致PARP-1的过度激活和Parthanatos的发生(图1)。Parthanatos的过程不同于细胞凋亡和其他调节性坏死。主要表现为:当Parthanatos发生时,PARP-1异常激活,产生大量对细胞有毒性作用的聚ADP核糖(Par);ATP和NADPH水平降低,进而导致线粒体膜去极化,释放AIF,AIF与MIF形成复合物后进入细胞核;AIF/MIF复合物促使染色质在核内凝结并产生大量DNA片段(15 KB到50 KB)。Parthanatos的发生依赖于PARP-1的过度激活,而半胱天冬酶(Caspase)不参与这一过程。PARP-1抑制剂或PARP-1基因缺失可以完全阻断Parthanatos的发生,而Caspase抑制剂不能抑制Parthanatos的发生。
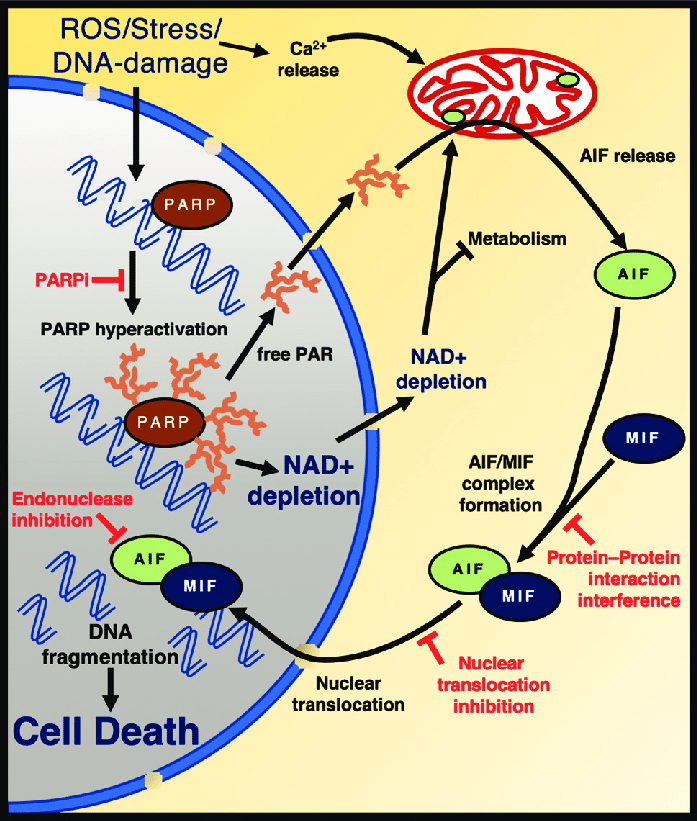
图1. PARP-1介导Parthanatos的发生
(图片来自《Genetics and Molecular Biology》)
Parthanatos与肿瘤发生和发展的关联
Parthanatos通过级联反应发挥作用,并在肿瘤发生中发挥多效性作用。其级联反应中的关键因子已被证实与肿瘤的发生和发展有关联。
PARP-1在肿瘤发生中的作用
PARP-1对肿瘤发生发展具有两面性。一方面,在快速增殖、放疗或化疗的过程中,DNA容易被破坏,导致肿瘤细胞凋亡。PARP-1最重要的功能之一是参与DNA修复,这有利于肿瘤细胞的生存。因此,通过抑制PARP-1的活性可以达到诱导肿瘤细胞凋亡的目的。另一方面,Parthanatos的发生主要来自PARP-1的异常激活,因此它也可以通过增强PARP-1的活性来抑制肿瘤细胞的增殖,从而导致肿瘤细胞中Parthanatos的发生。由于PARP-1参与许多DNA修复途径和基因组稳定性的维持,PARP-1活性的调节可作为相关癌症临床治疗的重要手段。
一项研究对8000多个肿瘤样本中PARP-1基因的表达进行了微阵列分析。结果显示PARP-1在乳腺癌症、卵巢癌症、子宫内膜癌症、肺癌症、皮肤癌症和非霍奇金淋巴瘤的表达水平高于同等数量的正常组织,这说明PARP-1与上述肿瘤密切相关。通过构建PARP-1基因敲除小鼠,发现PARP-1敲除小鼠的上皮癌风险显著降低。其机制是下调PARP-1蛋白水平可以抑制NF-κB的活性和NF-κB调节的促肿瘤相关蛋白的表达。此外,PARP-1基因敲除小鼠可以显著降低由AOM和DSS联合诱导的大肠癌的发病率。另通过机理研究发现,下调PARP-1蛋白水平可以通过抑制cyclin D和STAT3的表达来抑制诱导性大肠癌的发生。
AIF在肿瘤发生中的作用
AIF的转移发生在Par积聚的下游,是Parthanatos的关键步骤。之前的研究表明,AIF在控制肿瘤侵袭和转移方面发挥着至关重要的作用。在裸鼠原位移植瘤中,AIF的下调有助于促进上皮-间充质转化(EMT)过程,从而通过PTEN(一种肿瘤抑制物)的氧化失活促进癌症细胞的转移。在氧化应激等病理条件下,AIF表达降低导致氧化应激介导的PTEN活性失活,以及癌细胞中Akt、GSK-3β和WNT/β-catenin的激活增强,最终导致EMT的激活和癌细胞的转移。此外,据报道,AIF可以改善肿瘤的治疗耐药性。AIF的下调诱导非小细胞肺癌的化疗耐药性和人类T细胞淋巴瘤对辐射的耐药性。总之,AIF通过保护PTEN、抑制EMT以及抑制治疗耐药性来负调控肿瘤发生。因此,AIF可能是抗癌治疗的潜在靶点。
MIF在肿瘤发生中的作用
MIF被认为是Parthanatos过程中必不可少的一种蛋白,可导致Parthanatos中的广泛发生的DNA断裂。目前,人们普遍认为MIF通过几种不同的机制在肿瘤发生中发挥作用。首先,MIF可调节癌细胞自分泌和旁分泌作用中几种促炎分子的表达,如IL-6、IL-8、COX2和TLR4,从而促进肿瘤的增殖和进展。其次,MIF有助于免疫逃逸机制,并通过抑制细胞毒性T淋巴细胞和自然杀伤细胞来塑造肿瘤微环境,从而导致肿瘤的侵袭性。第三,MIF通过诱导bFGF、VEGF和HIF-1参与血管生成,从而促进肿瘤生长和进展。第四,MIF通过减少E-cad表达来促进EMT,从而增加肿瘤转移行为。实验和临床研究表明,MIF在几乎所有类型的人类癌症组织中高表达,并与肿瘤发展的所有阶段有关,包括乳腺癌症、结肠癌、癌症、前列腺癌症和宫颈癌症。总之,MIF通过多种机制促进肿瘤发生,阻断MIF信号可以减少癌症的形成和进展。
Parthanatos与肿瘤治疗方向
Parthanatos通过级联反应发挥作用,并在肿瘤发生中发挥多效性作用。其级联反应中的关键因子已被证实与肿瘤的发生和发展有关联。
癌症治疗中靶向PARP-1
目前科研和临床治疗中,常用靶向PARP-1的抑制剂和激活剂,通过调节PARP-1的活性来调控Parthanatos的发生,以找到癌症的途径。目前常用的PARP-1抑制剂包括Olaparib,Niraparib,Rucaparib,Talazoparib和Veliparib,这些均已获批用于BRCA1/2基因突变的乳腺癌、卵巢癌、前列腺癌的癌症治疗。基于PARP-1对肿瘤发生发展的两面性,一些PARP-1的激活剂也被用于癌症治疗研究。β-Lapachone,一种从拉帕乔树皮中获得的天然产物,通过NQO1/ROS介导的RIPK1-PARP1-AIF途径诱导Parthanatos,促进肝癌细胞死亡。添加PARP-1特异性抑制剂可阻断β-Lapachone诱导的细胞死亡。研究发现,一种从木槿中提取的可诱导癌细胞死亡的天然化学物质,6脱氧鬼臼毒素(DPT),在体外能诱导胶质瘤细胞死亡,在体内可抑制异种移植胶质瘤的生长,并伴有PARP-1表达上调、Par细胞质积累和AIF核转位等与Parthanatos相关的生化事件。
癌症治疗中靶向AIF
如前所述,AIF抑制肿瘤细胞增殖和转移。到目前为止,几种AIF靶向治疗药物(BZL101、Atiprimod、Flavopiridol)已用于抗癌治疗。BZL101是植物半枝莲的提取物,可促进AIF的易位,并特异性诱导癌症细胞(而非正常细胞)的细胞死亡。对晚期癌症患者进行的一期临床试验证明,BZL101治疗癌症是安全可行的。Atiprimod具有抗炎和抗血管生成特性,目前正在通过促进线粒体释放AIF来治疗转移性类癌和难治性多发性骨髓瘤。此外,一项研究报告了激活AIF有可能改善乳腺癌症化疗效果。总之,靶向AIF可能是一种通过诱导Parthanatos来根除肿瘤的优化的创新策略,迫切需要进行进一步的深入研究以及更多更大规模的临床试验。
癌症治疗中靶向MIF
MIF是一种潜在的靶向分子,它在Parthanatos通路及肿瘤发生中发挥关键作用。因此,抑制MIF可作为癌症治疗的新方向。目前,MIF靶向抑制主要分为三类:(1)使用MIF的抗体阻断MIF-CD74相互作用;(2)使用拮抗剂阻断MIF与CD74的结合和细胞内的相互作用,破坏MIF互变异构酶活性;(3)使用HSP90/HER2抑制剂,阻碍MIF稳定性间接干扰MIF。例如,用MIF 拮抗剂ISO-1抑制MIF可阻断MIF-CD74的结合和后续MIF功能,降低了前列腺癌DU-145细胞系的生长。据报道CPSI-1306可抑制MIF,通过结合MIF的互变酶区域并随后干扰MIF活性,减少了膀胱癌症细胞中VEGF的释放和增殖。HSP90是一种分子伴侣,可以结合MIF并保护其不被降解,而采用药物抑制HSP90则会破坏多种人类癌症细胞中MIF的稳定性。研究表明HSP90抑制剂Ganetespib抑制MIF,在转移性HER2阳性乳腺癌中有临床活性。此外,HER2的抑制可以阻断HSP90的激活,从而导致HER2过度表达的乳腺癌中MIF降解。鉴于这些结果,靶向MIF可能是一种有潜力的治疗方法。
云克隆相关产品
指标 | 核心货号 | 指标 | 核心货号 | 指标 | 核心货号 |
PARP-1 | NF-κB | RIPK1 | |||
AIF | STAT3 | BRCA1/2 | |||
BRCA2 | MIF | HER2 | |||
PTEN | GSK3b | β-catenin | |||
IL-6 | IL-8 | COX2 | |||
TLR4 | bFGF | HIF-1 | |||
E-cad | CD74 | HSP90 |
往期回顾