ARID1A突变的肿瘤治疗新策略:他汀类药物与免疫检查点阻断协同疗法
ARID1A是一种重要的抑癌基因,其编码SWI/SNF染色质重塑复合体中的一个亚基。该亚基的功能失调可引起染色质调节异常。ARID1A的突变频繁发生在各种癌症中,在卵巢透明细胞癌(OCCC)、子宫内膜癌、胃癌和膀胱癌中具有特别高的突变率。例如,有超过50%的OCCC存在ARID1A基因突变,导致OCCC对化疗无效,在所有卵巢癌亚型中预后最差,并缺乏较好的治疗方法。
2023年3月23日,美国MD Anderson癌症中心Rugang Zhang团队在《Cancer Cell》杂志发表了题为“Targeting the mevalonate pathway suppresses ARID1A-inactivated cancers by promoting pyroptosis”的研究论文。该研究揭示了在ARID1A缺失突变的肿瘤细胞中靶向甲羟戊酸信号通路,进而引发细胞焦亡。

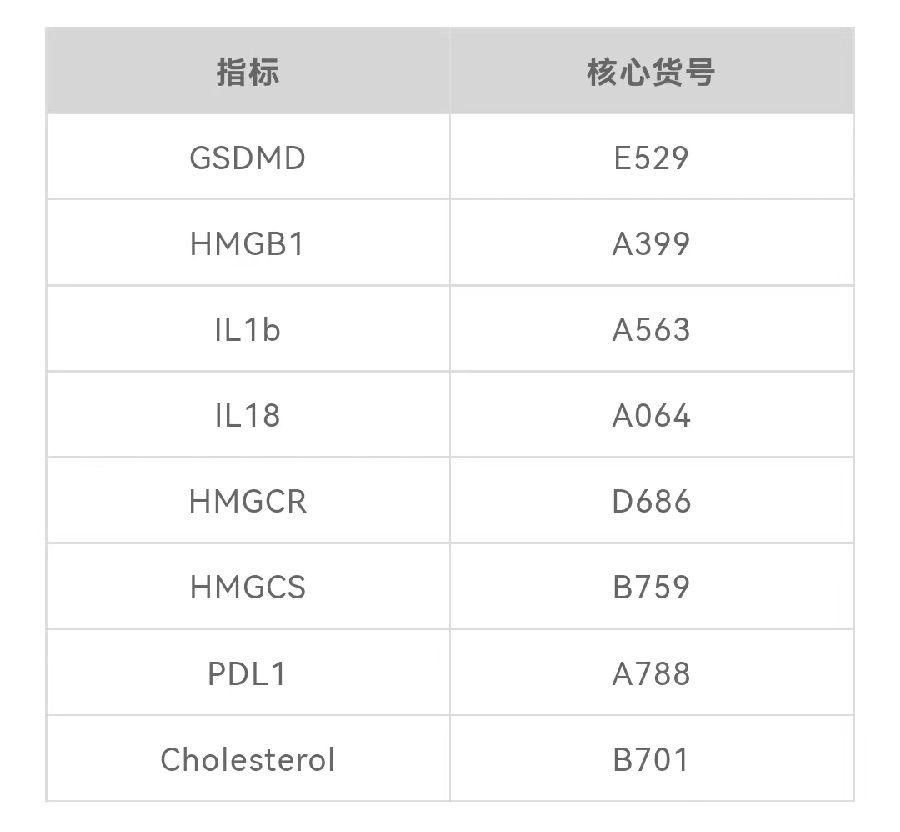
为了研究ARID1A在调节细胞焦亡中的作用,研究人员将ARID1A敲除的OVCA429 OCCC细胞与匹配的等基因ARID1A野生型进行对比。结果发现,与野生型细胞相比,在一组ARID1A突变OCCC细胞系中,细胞质DNA阳性的细胞百分比显著增高。值得注意的是,胞质双链DNA会触发cGAS通路的激活和/或炎症小体的形成。因此,研究人员通过对cGAS进行免疫荧光染色来确定cGAS通路的状态。他们使用依托泊苷(阻碍DNA修复的抗肿瘤药物)诱导细胞质染色质作为阳性对照。与依托泊苷处理的对照细胞相比,在ARID1A敲除细胞中,未定位到cGAS通路的激活。在ARID1A敲除和阳性对照细胞中,DNA损伤标志物γH2AX在细胞质DNA中均为阳性,但是敲低ARID1A并未增加2 ' 3 ' -cGAMP (cGAS的酶促产物)的水平。这些结果表明,在ARID1A敲除细胞中观察到的细胞质DNA不能激活cGAS。接下来,他们检测了对照组和ARID1A敲除细胞中炎症小体的形成。与对照相比,ARID1A敲除显著增加了焦亡的标志物,例如炎性小体形成以及裂解的半胱氨酸天冬氨酸蛋白酶1的表达和活性。通过药物刺激确定了ARID1A敲除使细胞对焦亡诱导性药物尼日菌素敏感。因此,ARID1A失活诱导炎症小体形成,并使细胞对诱导焦亡敏感。
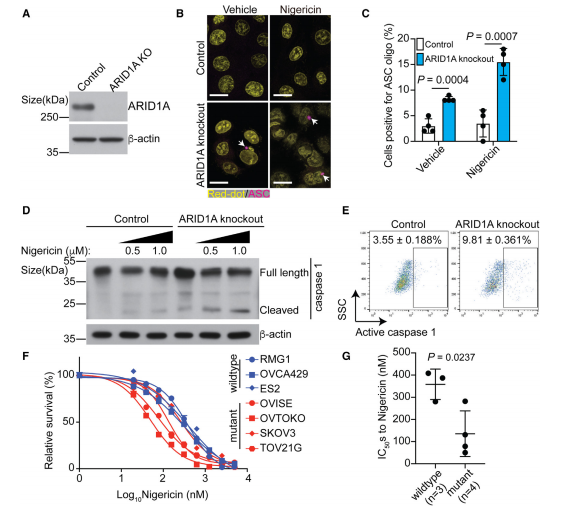
图1 ARID1A失活促使细胞焦亡
研究人员通过整合多种组学数据发现,甲羟戊酸/胆固醇通路是被ARID1A敲除抑制的主要通路之一。通过使用甲羟戊酸通路抑制剂(如辛伐他汀和阿托伐他汀)处理对照组和ARID1A敲除细胞。与对照细胞相比,他汀类药物诱导ARID1A敲除细胞的炎症小体形成显著增加。透射电子显微镜分析显示,在辛伐他汀处理的ARID1A敲除细胞中,有许多质膜断裂,这是细胞焦亡的特征。同样,与对照细胞相比,在ARID1A敲除细胞中,细胞焦亡的其他标志物(如cleaved caspase 1和cleaved GSDMD)的诱导水平更高。辛伐他汀处理后,ARID1A敲除导致HMGB1、IL-1b和IL-18分泌增加。这表明,辛伐他汀在ARID1A失活细胞中诱导的细胞焦亡水平显著升高。
ChIP-seq分析显示,ARID1A与编码甲戊酸途径限速酶的HMGCR和HMGCS1基因的启动子相关。ARID1A敲除后HMGCR(羟甲基戊二酸单酰辅酶A还原酶)和HMGCS1(3-羟基-3-甲基戊二酰辅酶A合酶1)在mRNA和蛋白水平下调。敲低ARID1A野生型细胞中的HMGCS1,该细胞表现为对辛伐他汀敏感。而外源加入该通路的中间产物甲羟戊酸或GGPP(香叶基-香叶基焦磷酸)导致细胞对他汀类药物的脱敏。这些结果表明,ARID1A失活通过下调HMGCR和HMGCS1降低甲羟戊酸通路活性,使得细胞更加依赖于该通路。
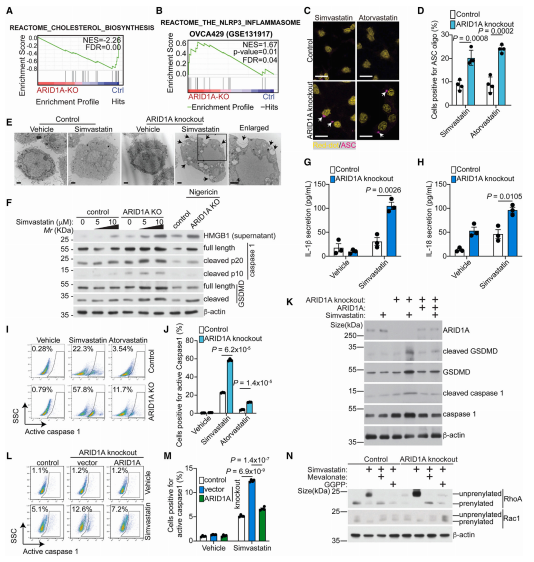
图2 抑制甲羟戊酸途径使ARID1A失活细胞对焦亡敏感
为了确定体内ARID1A状态是否影响对甲羟戊酸途径抑制的敏感性,研究人员使用ARID1A野生型RMG1 OCCC细胞或匹配的等基因ARID1A敲除的RMG1细胞形成的卵巢肿瘤原位异种移植模型。将细胞原位移植到覆盖免疫抑制裸鼠卵巢的囊内,以模拟肿瘤微环境,建立原位癌模型。然后将小鼠随机分组,每周给予溶媒对照或辛伐他汀(10 mg/kg)治疗3周。辛伐他汀处理显著降低了由ARID1A敲除RMG1细胞形成的原位异种移植物的负担。相比之下,辛伐他汀对对照RMG1细胞形成的肿瘤的生长没有显著影响。因此,观察到的辛伐他汀治疗的肿瘤抑制作用是依赖于ARID1A失活。将这些研究扩展到OCCC患者来源的异种移植(PDX),得到了相似的结果。虽然抑制甲羟戊酸途径可以抑制ARID1A失活的卵巢癌的生长,但单靠辛伐他汀不足以根除ARID1A失活的卵巢癌。
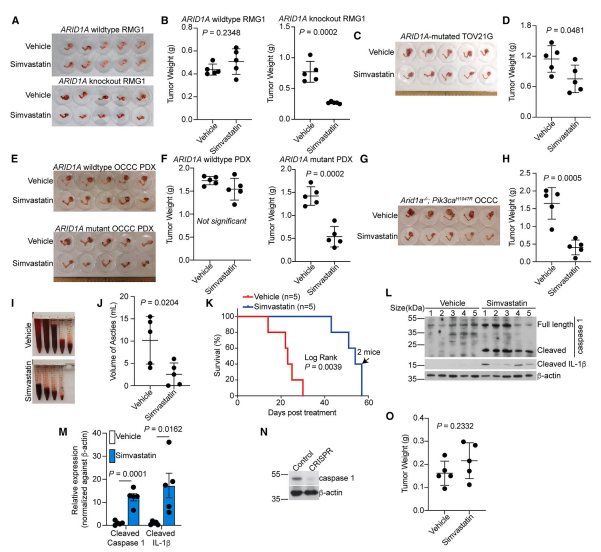
图3 辛伐他汀抑制体内ARID1A失活OCCC的生长
有相关研究表明ARID1A的功能性缺失会使肿瘤对免疫检查点抑制剂疗法(ICB)变得敏感。而抗PD-L1可有效治疗ARID1A突变型卵巢癌。那么甲羟戊酸通路抑制联合抗PD-L1抗体可能在抑制ARID1A失活的卵巢癌方面发挥协同作用。在Arid1a- /-;Pik3caH1047R免疫正常的OCCC遗传小鼠模型中研究了辛伐他汀是否与抗PD-L1有协同作用。与任一单独治疗相比,辛伐他汀联合抗PD-L1治疗在减少腹水产生和肿瘤负荷方面具有显著效果。根据Filipin III染色结果,辛伐他汀降低了肿瘤内胆固醇水平,改善了CD8+ T细胞耗竭。最后,研究人员将联合研究扩展到人源化患者ARID1A突变OCCC模型,观察到辛伐他汀和抗PD-L1在降低肿瘤负荷方面存在类似的协同作用,并且联合用药所使用的剂量耐受性良好。例如,联合用药未显著影响接受治疗的荷瘤小鼠的体重。此外,联合用药未明显改变肝、肾和脾的组织学形态。因此,在抑制ARID1A失活的OCCC生长方面,甲羟戊酸途径的抑制与免疫检查点阻断具有协同作用。

图4 辛伐他汀与抗PD-L1协同抑制ARID1A失活的OCCC
这项研究结果证明他汀类药物和ICB联合使用在抑制ARID1A突变肿瘤方面具有协同作用。这一联合用药利用了甲羟戊酸途径抑制的肿瘤内在效应及其在肿瘤微环境中增强抗肿瘤免疫的作用。ARID1A是最常发生突变的表观遗传调控因子,在20%的人类癌症中SWI/SNF会发生改变,因此,这项成果对开发这些癌症急需的治疗方法具有深远影响。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考: