这种药物可使铜失活进而抑制炎症反应
炎症是一个复杂的生理过程,是对有害刺激的反应,由于感染导致的过度炎症,是一系列疾病的标志。目前,炎症反应背后的分子基础尚不完全清楚,治疗严重炎症的有效药物也很少。2023年4月,《Nature》杂志上发表了一篇题为“A druggable copper-signalling pathway that drives inflammation”的文章,在这项研究中,研究者研究了线粒体铜(ii)催化烟酰胺腺嘌呤二核苷酸及其还原态(NAD(H))氧化还原循环,从而促进代谢变化进而引发炎症状态。设计了一种二甲双胍二聚体(LCC-12),靶向线粒体铜(ii)失活,诱导代谢和表观遗传变化,抑制巨噬细胞活化和减轻炎症反应。

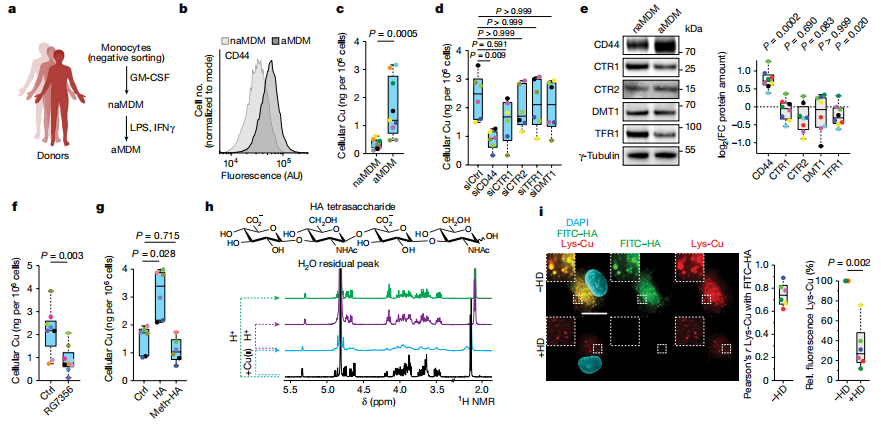
研究者用从人血液中分离出原代单核细胞产生炎性巨噬细胞。通过电感耦合等离子质谱(ICP-MS)检测到活化单细胞源的巨噬细胞(aMDMs)中细胞铜、铁、锰和钙的表达水平高于非活化单细胞源的巨噬细胞(naMDMs)。与其他金属转运蛋白(转铁蛋白受体1(TFR1)、二价金属转运体1(DMT1)、铜转运体1(CTR1))相比,敲除糖蛋白CD44可拮抗金属摄取。用抗CD44抗体处理单核细胞来源的巨噬细胞(MDMs)发现巨噬细胞激活后金属摄取减少。在巨噬细胞激活后补充透明质酸增加了细胞对金属的摄取,而添加不易与金属结合的过甲基化透明质酸则没有效果。核磁共振的结果显示透明质酸与铜(ii)相互作用,这种相互作用可以通过降低pH来逆转。荧光显微镜结果显示,标记的透明质酸与溶酶体铜(ii)探针同时定位在aMDMs中,降解透明质酸盐或敲除CD44的透明质酸酶共处理可降低溶酶体铜(ii)染色。这些数据证明了在aMDMs中,CD44介导与透明质酸结合的特定金属的内吞作用,包括铜。(见图1)
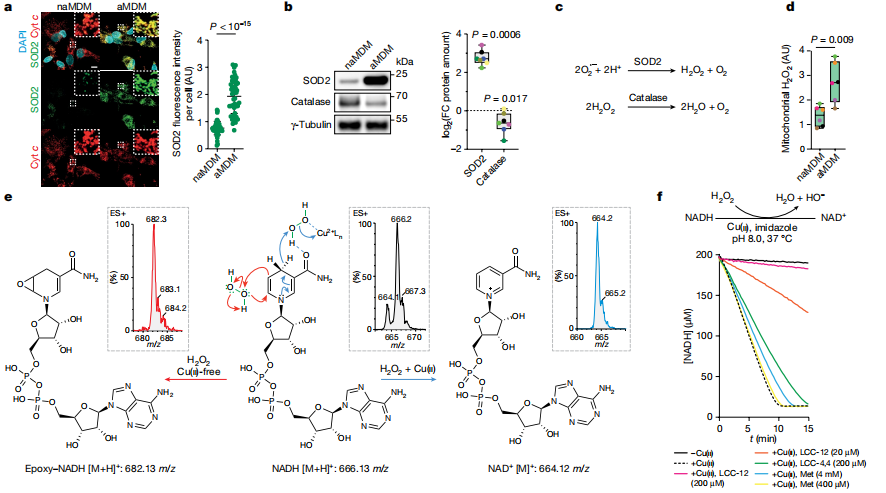
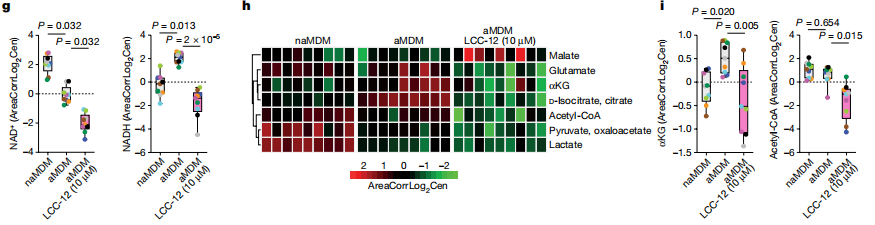
在铜(ii)存在的情况下,NADH与过氧化氢反应生成NAD+,而在铜(ii)不存在的情况下,则生成复杂的氧化产物混合物。研究者模拟了与线粒体相似的反应条件,NADH在铜(ii)的存在下被迅速消耗以产生NAD+。同时,研究者设计了2种亲脂性亚甲双胍LCC-12和LCC-4,4、LCC-12能抑制NADH与过氧化氢反应生成NAD+,而LCC-4,4的作用则不大。在激活过程中,用LCC-12处理MDMs,代谢组学结果显示NADH和NAD+数量减少。这表明铜(ii)催化NADH还原过氧化氢产生NAD+,双胍类化合物可以干扰这种氧化还原循环,导致其他氧化副产物。代谢组学热图显示,在经LCC-12(n = 9)处理的MDMs中,其生物合成依赖于NAD(H)的代谢物。这些数据说明了线粒体铜(ii)在调节炎症巨噬细胞代谢状态的NAD+含量的核心作用。(见图2)
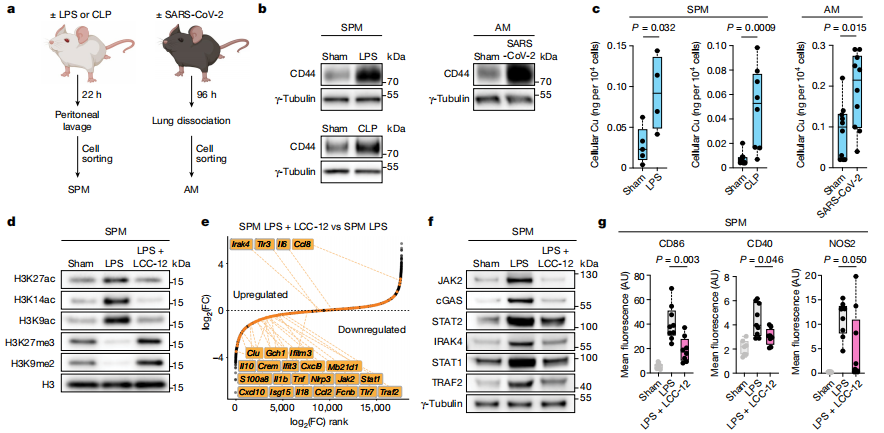
研究者构建了小鼠急性炎症模型:脂多糖(LPS)诱导的内毒素血症、盲肠结扎穿刺(CLP)和病毒感染模型,即SARS-CoV-2。研究者从LPS和CLP小鼠模型中分离得到炎症状态下的小腹膜巨噬细胞(SPMs)以及从SARS-CoV-2感染小鼠中分离得到肺泡巨噬细胞(AMs),SPMs和AMs细胞中CD44表达量上调,细胞铜显著增加。LPS处理的小鼠腹腔注射LCC-12,发现与炎症相关的组蛋白H3K27ac、H3K14ac和H3K9ac减少,H3K27me3和H3K9me2增加。Kaplan-Meier生存曲线结果显示,腹腔注射LCC-12阻止小鼠免于LPS诱导的死亡和体温降低,效果优于临床用于急性炎症治疗的大剂量地塞米松。在CLP诱导的脓毒症中,LCC-12也提高了生存率。这些数据表明,靶向线粒体铜(ii)干扰体内炎症状态,有益于治疗。(见图3)
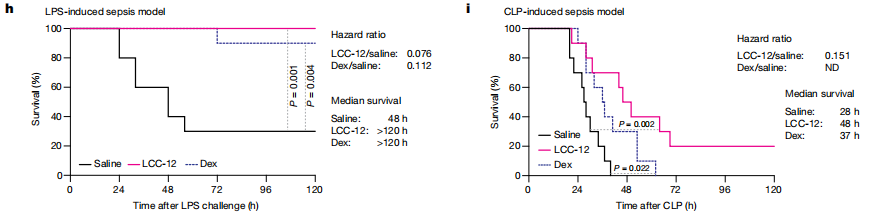
总的来说,这些发现证明CD44介导铜调节免疫细胞的激活。通过铜(ii)激活过氧化氢使NADH氧化,增加NAD+含量。LCC-12能使线粒体铜(ii)失活,从而触发代谢和表观遗传改变,减少炎症细胞状态,提高急性炎症临床前模型的存活率,揭示了基于表观遗传细胞状态控制和微调的治疗策略。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考。
指标名 | 核心货号 | 指标名 | 核心货号 |
CD44 | A670 | NAD | G409 |
LPS | B526 | CD28 | A652 |
HA | A182 | ND1 | Q301 |
SOD2 | B083 | CytC | A594 |
CXCL9 | B928 | CAT | C418 |
CCL8 | A088 | IRAK4 | B518 |