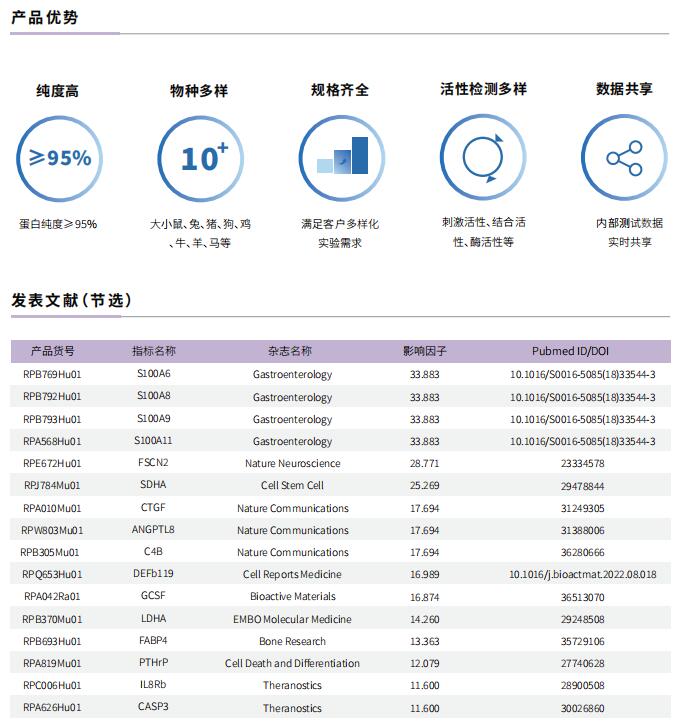
文献解读 | DNA框架工程嵌合体平台实现选择性靶向蛋白质降解

2023年7月27日,中国药科大学工程学院生物医学工程系Yi Ma团队在《Nature Communications》上发表题为“DNA framework-engineered chimeras platform enables selectively targeted protein degradation”的文章,他们构建了具有可编程连接体的DNA框架工程蛋白水解靶向嵌合体,提供了对一般蛋白降解剂设计的见解,为药物开发提供帮助。

在这篇文章中,云克隆蛋白【Cereblon蛋白(CRBN)重组蛋白,RPG676Hu01】受到科研工作者的认可,荣登优秀国际期刊。

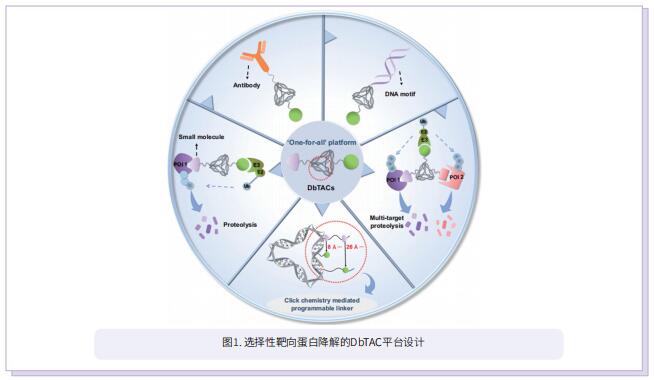
蛋白质靶向降解是一种新兴的治疗疾病的策略,特别是蛋白水解靶向嵌合体(PROTAC)。PROTAC是非双功能分子,包括靶向目的蛋白质的配体、招募E3连接酶的配体和连接上述两个部分的接头。其中,连接体在桥接这两个部分中起着关键作用。虽然已经研究了许多传统的连接体,包括PEG、线性脂族链和更刚性的连接体,但设计有效的连接体仍然具有挑战性。最近,DNA已被设计成DNA框架,如DNA四面体、八面体和二十面体,具有良好的表面化学可控制性能。这些DNA框架的刚性、可寻址性和人工可编程性为它们提供了类似连接器的属性。此外,基于小窝蛋白介导的DNA框架内吞机制,以DNA框架作为连接体有助于改善传统PROTAC进入细胞效率较差的问题。
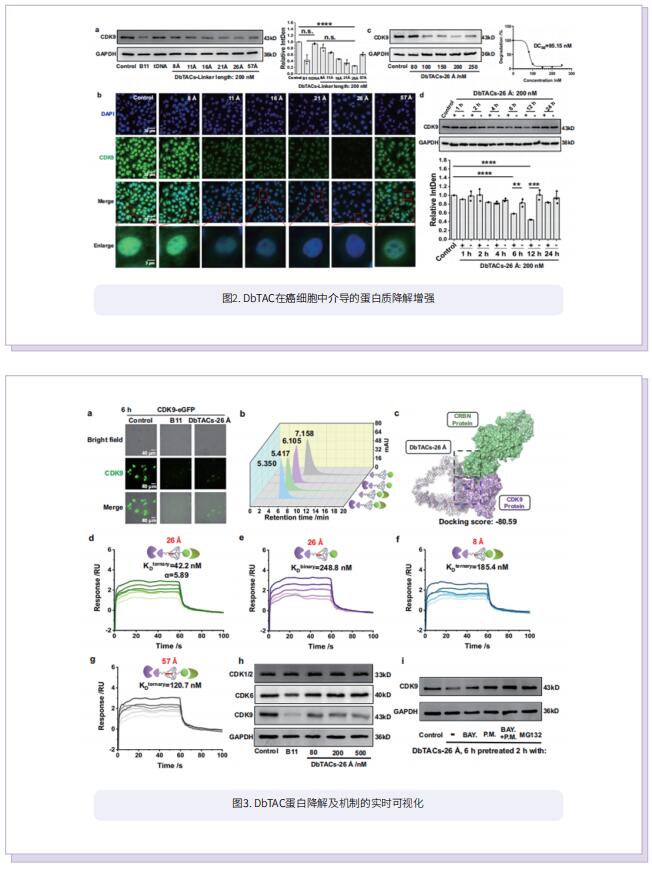
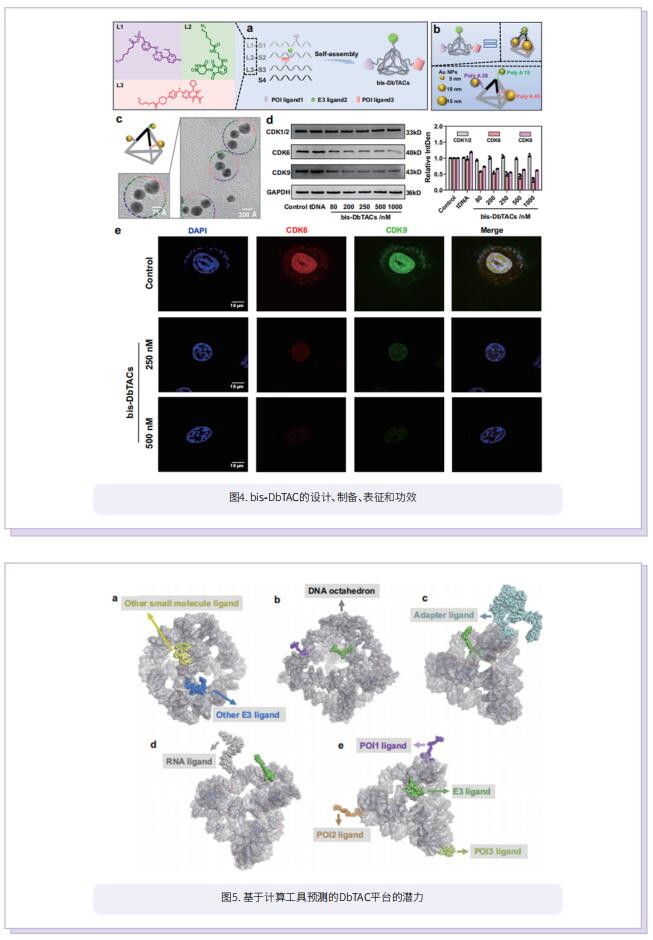
受DNA框架独特特性的启发,作者结合计算预测、DNA自组装和PROTAC技术,开发了一种基于DNA框架的PROTAC(DbTAC)的创新策略。为了研究连接体的长度-活性关系,他们采用DNA四面体、细胞周期蛋白依赖性激酶(CDK)家族蛋白和cereblon(CRBN) E3连接酶的配体形成的DbTAC作为代表性模板。具体而言,CDK9配体的位置是固定的,而CRBN配体在DNA四面体上穿梭,产生连接体长度从8Å到57Å的DbTAC。他们对不同连接体长度的DbTAC进行了可视化研究,发现26Å的最佳DNA连接体长度在体外最有效。结合亲和力的差异解释了连接体长度-活性关系的机制。此外,他们通过创建共享一个CRBN配体的双特异性DbTAC(双-DbTAC)成功证明了DbTAC的可行性,该DbTAC可选择性降解癌症细胞系中的CDK6(一种参与细胞增殖和分化的蛋白质)和CDK9(一个参与转录调节、DNA修复和代谢的蛋白质)。为了扩大该平台靶向范围,基于抗体和DNA基元的DbTAC也被开发出来,促进CDK9激酶和ETS相关基因(ERG)转录因子的降解。
综上所述,作者提出了具有可编程连接体的DNA框架工程DbTAC。与传统的PROTAC相比,DbTAC提供了一种模块化的方法来生成蛋白靶向降解剂。这种方法有效地减少了制备连接体本身所涉及的步骤,以及随后连接体与配体的偶联,在开发更有效的药物生产方法方面迈出重要一步。
云克隆活性蛋白基于GMP级开发,能够提供各种规格,以满足基础科学实验、药物筛选、动物给药等各方面的实验需求。