肠炎相关:Aiolos竟可抑制肠上皮内淋巴细胞激活
肠上皮是大量上皮内T细胞的家园,包括主要的肠上皮内淋巴细胞(IELs),以及较少的上皮内先天淋巴细胞(ILCs)。IELs的激活失调是导致乳糜泻和炎症性肠病的发病机制。诱导IELs激活的机制被广泛研究,但调节IELs的机制仍然不完全明确。2023年12月,《Nature immunology》杂志上发表了一篇题为“The transcription factor Aiolos restrains the activation of intestinal intraepithelial lymphocytes”的文章,在这项研究中,研究者发现由IKZF3编码的Ikaros锌指家族成员Aiolos通过减弱IL-15信号传导,在一定程度上控制了非常规T细胞群(uIELs)中编码NK1.1等其他NK受体、细胞毒性介质和IFN-γ的表达。Aiolos通过与STAT5和RUNX家族成员协调的表观遗传修饰调节uIELs的效应程序,从而得以控制肠道炎症。

研究者通过流式细胞术发现Ikzf3−/− uIELs中NK受体NK1.1的表达量高于Ikzf3+/+ uIELs。Ikzf3−/−小鼠的IEL亚群表型分析表明,NK1.1在CD45+CD3+ TCRγδ+细胞群(γδ uIELs)和CD45+CD3+TCRγδ -TCRαβ+CD4 -CD8β-CD8α+细胞群(DN uIELs)以及CD45+CD3+TCRγδ -TCRαβ+CD4+CD8β-CD8α+细胞群(DP IELs)都有表达。RNA测序结果证明,Ikzf3−/− γδ uIELs和Ikzf3−/− DN uIELs表现出广泛的重编程,NK受体、颗粒酶、各种细胞因子和趋化因子以及抗凋亡分子Bcl2、检查点抑制剂和细胞内调节剂Lair1、Lag3和Socs3的表达量上调,说明了Aiolos在uIELs中表达且可以抑制uIELs的激活程序。随后研究者将遗传标记的Ikzf3+/+和Ikzf3−/−小鼠骨髓共同注射到亚致死辐照的Rag1−/−小鼠中,发现Aiolos以细胞固有的方式抑制了NK受体、细胞毒性酶和IFN-γ在 γδ uIELs和DN uIELs中的表达。(见图1)
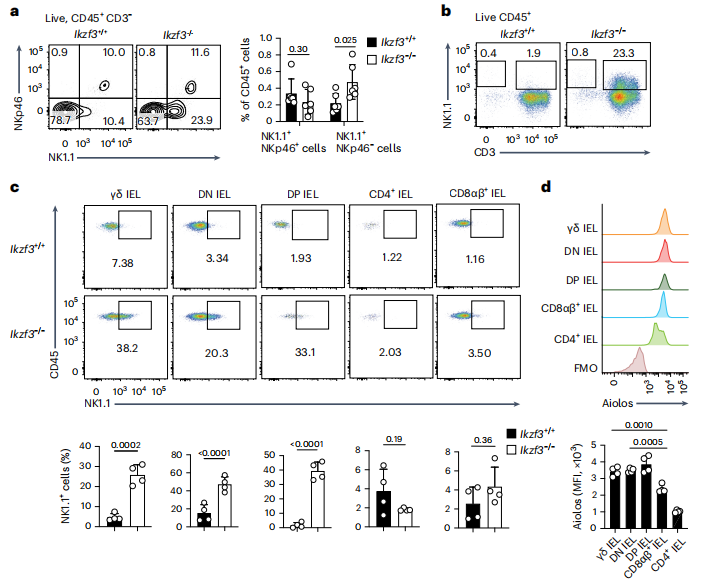
图1 Aiolos调控uIELs的激活
(图片来源于《Nature immunology》杂志)
从Ikzf3+/+和Ikzf3-/-小鼠的小肠上皮中分离出活性CD45+细胞进行单细胞RNA-seq(scRNA-seq)测序并进行可视化分析。CD8αα+ uIELs计算重新聚类后,区分出三种主要的集群:Tcf7+ uIELs、Tcf7−Il2rbhi uIELs和Tcf7−Il2rblo uIELs。测序数据显示,Tcf7−Il2rbhi在每个基因型中形成了一个单独的簇,Tcf7−Il2rblo在Ikzf3−/−中的含量低于Ikzf3+/+,而其他集群受Aiolos缺乏的影响较小。Ikzf3−/− uIELs中上调的基因包括Ccl4、Ifng、颗粒酶基因和NK受体基因。从三个集群的差异基因火山图显示,Ikzf3缺失在Tcf7−Il2rbhi集群中的影响最为明显,与Ikzf3+/+ uIELs相比,Ikzf3−/− uIELs中颗粒酶和NK受体等效应基因上调。综上所述,Aiolos缺陷优先影响Tcf7−Il2rbhi CD8αα+ uIELs,增强与激活受体和效应功能相关的基因表达程序。(见图2)
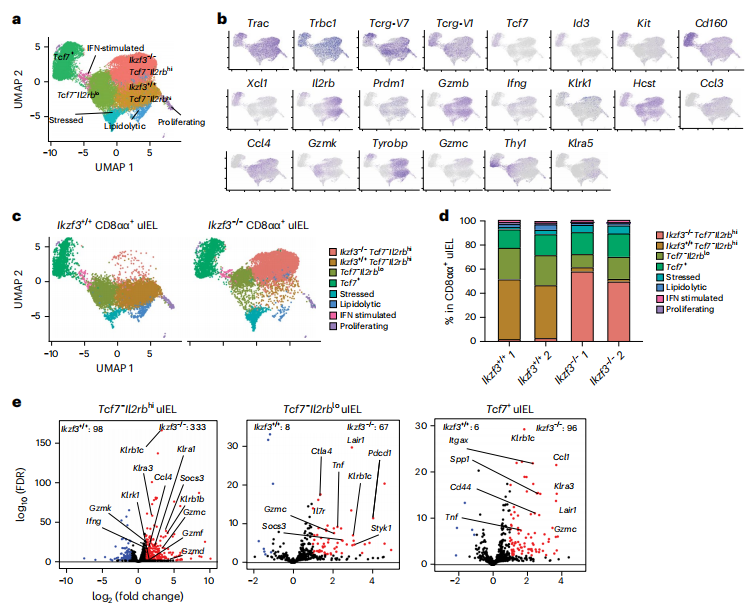
图2 Aiolos影响CD8αα+ IELs的Tcf7-Il2rbhi亚群
(图片来源于《Nature immunology》杂志)
流式细胞术分析了Ikzf3+/+和Ikzf3−/−小鼠CD8αα+ uIELs中TCF1(由Tcf7编码)和CD122(由Il2rb编码)的蛋白表达情况。CD8αα+ uIELs包含三个细胞亚群:TCF1+ uIELs,TCF1-CD122hi uIELs和TCF1-CD122lo uIELs。Nk1.1在Ikzf3−/−和Ikzf3+/+ uIELs中的表达都是在TCF1-CD122hi uIELs中最高。从Ikzf3−/−和Ikzf3+/+小鼠小肠的不同片段中纯化CD45+细胞,在Ikzf3−/−小鼠中,NK1.1的表达在十二指肠的uIELs中最高,远段的uIELs逐渐减少。γδ uIELs和DN uIELs的流式细胞分析显示,IL-15以剂量依赖的方式诱导NK1.1的表达,在Ikzf3−/− uIELs中的表达量更高。(见图3)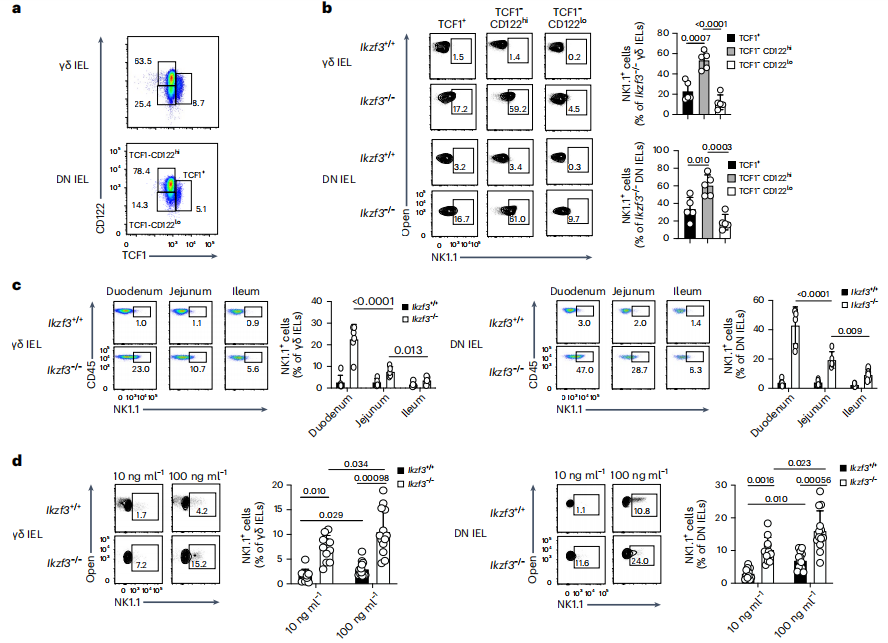
图3 Aiolos缺失导致IELs对IL-15的超敏反应
(图片来源于《Nature immunology》杂志)
为了明确激活IELs的炎症反应是否会协同降低Aiolos表达,研究者给Ikzf3+/+小鼠腹腔注射多肌苷:多胞酸(poly-I:C)形成炎症模型。1天后与空载对照组小鼠相比,给药组中Aiolos在γδ uIELs和DN uIELs中的表达明显下调。与单独使用IL-2和IL-15培养的uIELs相比,这两种刺激都下调了Aiolos在uIELs中的表达,表明炎症条件下调了Aiolos的表达。接着,研究者构建了一个急性结肠炎模型,发现与Ikzf3fl/fl uIELs相比,E8ICre Ikzf3fl/fl uIELs中NK1.1和颗粒酶C表达量更高。用葡聚糖硫酸钠(DSS)处理Ikzf3fl/fl和E8ICreIkzf3fl/fl小鼠4天后,E8ICreIkzf3fl/fl小鼠比Ikzf3fl/fl小鼠表现出更多的粪便血,更短的结肠长度,更突出的溃疡和更高的隐窝损伤,表明CD8α+细胞Aioloos缺乏加重了化学诱导的结肠炎。(见图4)
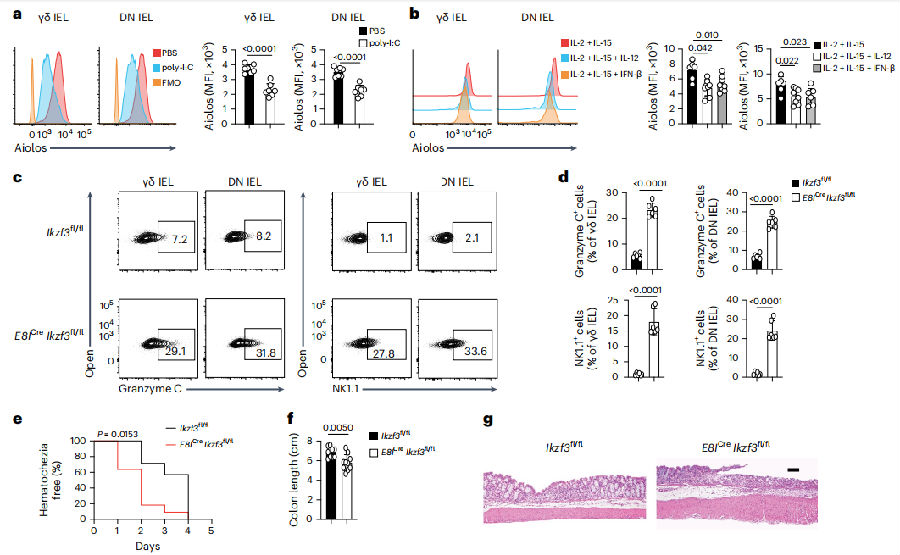
图4 炎症条件控制Aiolos表达
(图片来源于《Nature immunology》杂志)
对Aiolos结合位点相关基因的通路分析显示,TCR信号通路和NK细胞介导的细胞毒性通路富集。利用Homer de novo对Aiolos结合位点富集的基序进行分析,发现IKZF普遍结合GGGAA基序。将CUT&RUN-seq分析中与Aiolos结合位点相关的基因与RNA-seq分析中的差异表达基因(DEGs)进行比较,研究者发现Aiolos结合基因包括NK细胞受体,细胞毒性酶,趋化因子和Aiolos靶基因如Irf8。通过比较STAT5和Aiolos的全基因组分布,数据表明Aiolos-STAT5重叠区域位于NK受体,颗粒酶B和趋化因子。另外,研究者发现Aiolos结合区与其他转录因子的结合位点重叠,并在RUNX基元中特异性富集。Aiolos和RUNX结合位点的全基因组分布比较显示,γδ uIELs和DN uIELs中分别有4250个和2289个与RUNX1重叠,γδ uIELs和DN uIELs中分别有726个和351个与RUNX3重叠。综上所述,这些数据表明Aiolos可能与STAT5和RUNX家族成员协同调节某些基因组位点的基因表达。(见图5)
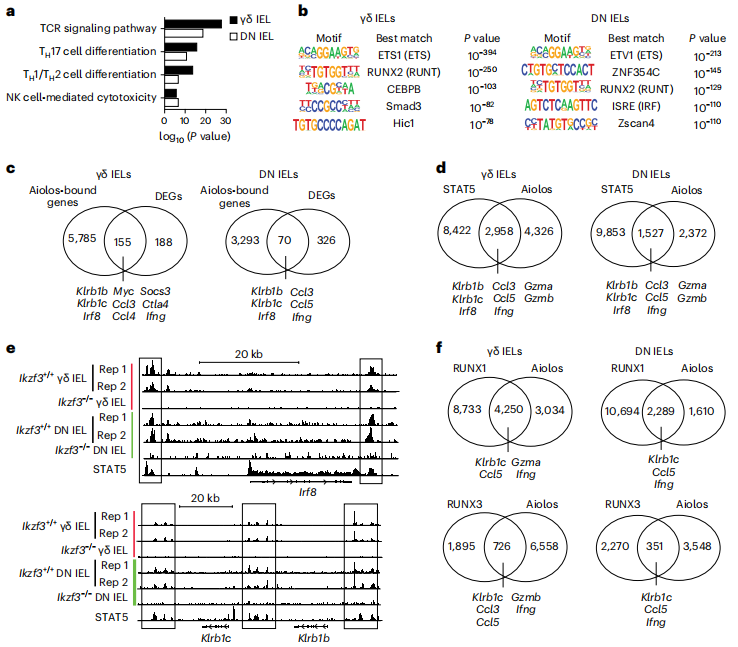
图5 Aiolos在IEL效应基因和STAT5结合区附近结合
(图片来源于《Nature immunology》杂志)
研究者使用转座酶染色质可及性测序(ATAC-seq)测定了相同uIEL亚群中染色质可及性的全局变化。对乙酰化组蛋白H3Lys27(H3K27ac)峰进行分析显示,与Ikzf3+/+ γδ uIELs相比,Ikzf3−/−中的乙酰化程度更高。Ikzf3−/−γδ uIELs和DN uIELs中的H3K27ac峰与Ikzf3−/− γδ uIELs和DN uIELs中上调的基因相关,包括NK受体、趋化因子和颗粒酶C。Ikzf3−/− uIELs中更易接近的染色质区域与NK受体、趋化因子和Aiolos靶基因相关,表明启动子和增强子区域的ATAC差异峰也与DEGs相关。综上所述,Aiolos调节染色质可及性,促进组蛋白去乙酰化,并可能干扰其他转录因子来调节IEL效应基因的表达,包括NK受体、趋化因子和颗粒酶。(见图6)
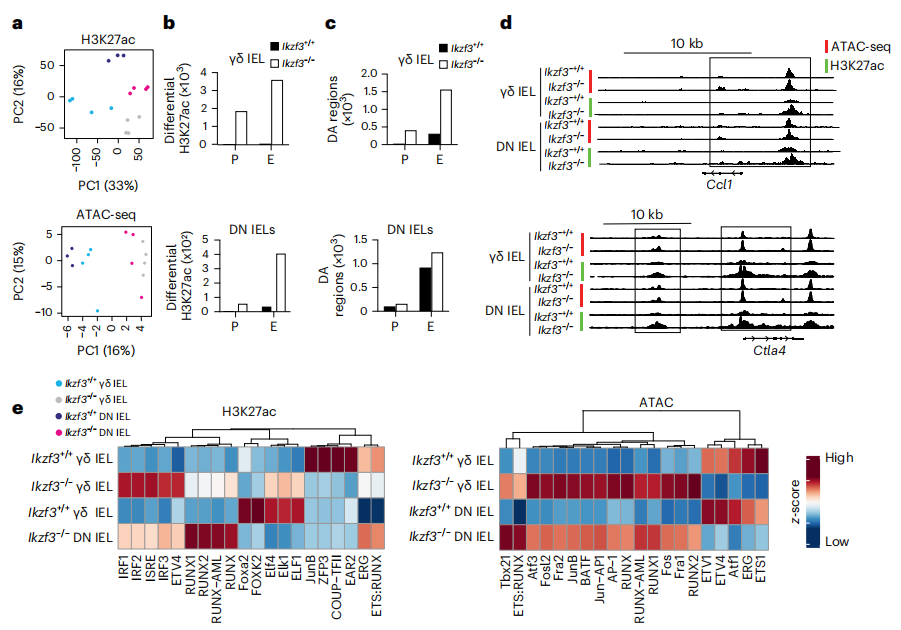
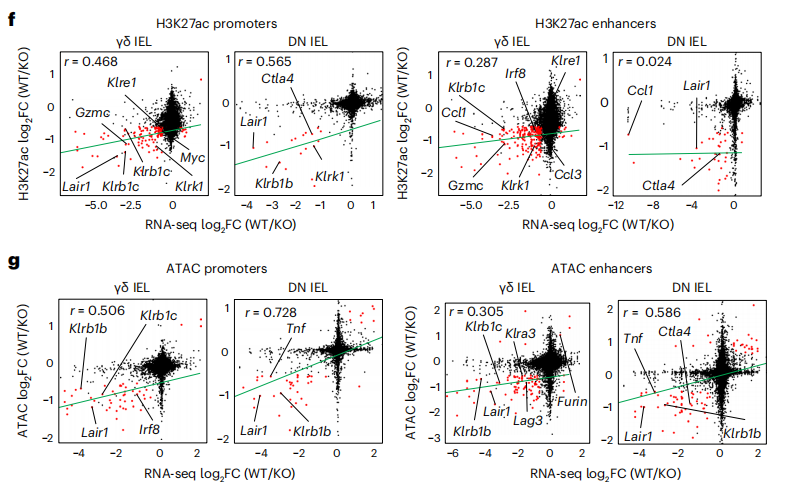
图6 Aiolos在uIELs中形成不同的表观遗传景观
(图片来源于《Nature immunology》杂志)
总的来说,这些发现说明Aiolos在抑制uIEL中NK受体、细胞毒性介质、趋化因子和IFN-γ表达方面具有关键作用,可能有助于解释炎症性肠病与Aiolos表达之间的关联,强调了Aiolos在维持肠道稳态和预防炎症中的重要意义。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考:
指标名 | 指标名 | 核心货号 | |
IL15 | A061 | CD3d | B872 |
CD8a | B099 | CD4 | B167 |
IgG | A544 | CD11c | B159 |
IFNg | A049 | CD8b | Q127 |
CD314 | B765 | CD122 | A229 |
CD159a | A990 | CD161 | A986 |
更多信息,欢迎访问http://www.cloud-clone.com/。