神经胶质瘤突触招募适应性可塑性的机制
 癌细胞通过操纵正常的生物学过程促使自身不断增殖。神经系统在癌症调节中的作用越来越受到重视。脑源性神经营养因子BDNF(brain-derived neurotrophic factor)是大脑中神经元突触可塑性的关键介质,它对神经元的形态和生理功能发挥至关重要,可促进神经元生长以及大脑神经细胞突触的形成和稳定。
癌细胞通过操纵正常的生物学过程促使自身不断增殖。神经系统在癌症调节中的作用越来越受到重视。脑源性神经营养因子BDNF(brain-derived neurotrophic factor)是大脑中神经元突触可塑性的关键介质,它对神经元的形态和生理功能发挥至关重要,可促进神经元生长以及大脑神经细胞突触的形成和稳定。
近期来自斯坦福大学神经学科的研究者们在《Nature》上发表了题为“Glioma synapses recruit mechanisms of adaptive plasticity”的文章,这一突破性的研究发现胶质瘤通过BDNF使用神经元活动,这一举动与健康脑细胞相同:BDNF由神经元传至肿瘤细胞,激发细胞内部连锁反应,助力肿瘤形成更加复杂和强大的突触网络。
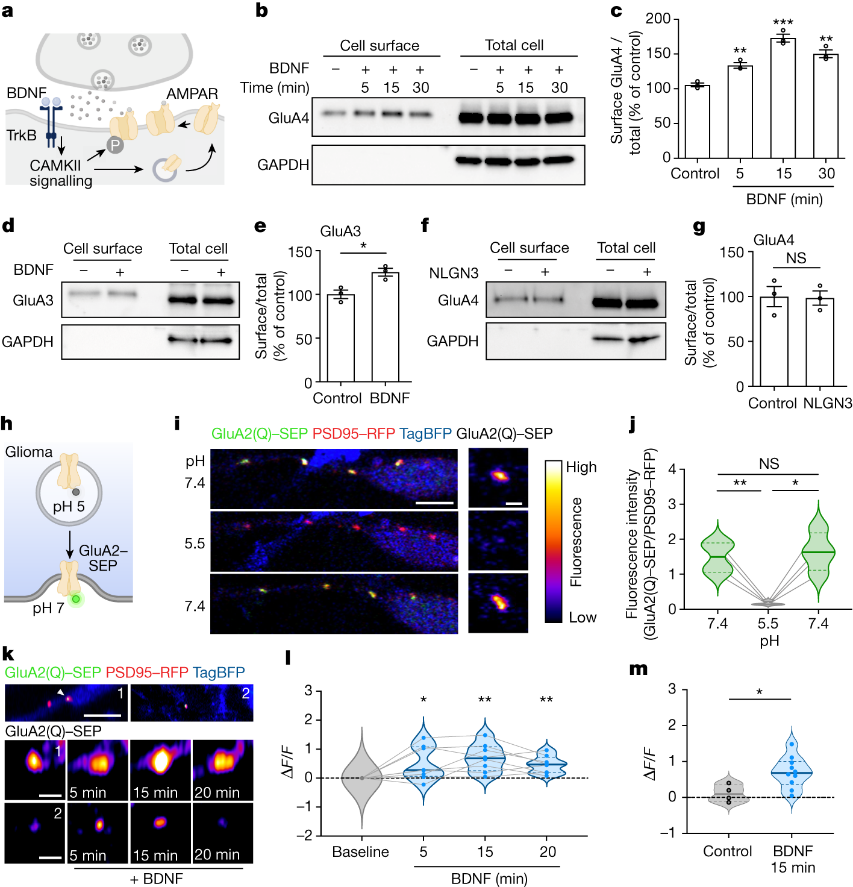
由于小儿胶质瘤恶性细胞中BDNF受体TrkB呈高表达,但却不表达BDNF,说明其中的BDNF来自于外部微环境。因此,研究者通过缺乏BDNF活性诱导表达的基因工程小鼠模型(Bdnf-TMKI)测试了神经元活性调节的BDNF分泌到肿瘤微环境中的作用。研究者在Bdnf-TMKI小鼠的深层皮质投射神经元中表达兴奋性蓝光门控视蛋白通道rhodopsin-2(图1a),以实现皮质投射(谷氨酸能)神经元活动的光遗传刺激。将患者来源的小儿胶质瘤(DIPG)细胞异种移植到额叶皮层和皮层下白质中,在移植5周后,用既定的方案(每天10分钟,20Hz蓝光刺激,30秒开/90秒关周期)刺激皮质投射神经元活动,持续1周。正如预期的,作者观察到BDNF野生型小鼠在受刺激后胶质瘤增殖增加。在缺乏BDNF活性调节的表达和分泌的Bdnf-TMKI小鼠中,皮质投射神经元活性调节对胶质瘤增殖的影响明显减弱(图1b-d)。
鉴于以上结果,研究者接下来探讨了神经活性调节的BDNF对BDNF野生型和携带DIPG异种移植物Bdnf-TMKI小鼠的存活率影响。结果发现,神经元活动调节的BDNF表达和分泌的丧失导致脑干中携带患者来源DIPG异种移植物的Bdnf-TMKI小鼠生存优势明显增加(图1e),这与活动调节的BDNF信号在脑微环境中强烈影响胶质瘤进展的假设一致。
研究表明,BDNF通过TrkB(由NTRK2编码)受体作用于神经胶质瘤细胞,并且BDNF是儿童神经胶质瘤对其作出反应的关键神经营养因子。因此,作者测试了遗传或药理学TrkB阻断对小儿胶质瘤生长的影响。将小鼠与患者来源的细胞原位异种移植。与移植了NTRK2野生型细胞的对照组相比,移植了脑干NTRK2-KO DIPG或额叶皮层NTRK2-KO儿科皮质胶质母细胞瘤的小鼠的总体存活率显著增加(图1f)。使用抑制剂治疗侵袭性患者源性小儿胶质瘤(DIPG)原位异种移植模型可提高总生存率(图1g)。说明抑制剂对DIPG的作用机制是通过TrkB介导的。
后期作者通过将神经元与NTRK2野生型或NTRK2-KO胶质瘤细胞共培养来研究BDNF-TrkB信号传导在神经元-胶质瘤相互作用中的相对贡献。结果表明,在缺乏神经元的情况下,TrkB损失并不会降低小儿胶质瘤细胞的增殖(图1i)。与神经元共培养相比,BDNF配体单独作用下TrkB损失引起的胶质瘤增殖变化的程度(图1h,i)。表明BDNF在神经元-胶质瘤相互作用中可能具有更复杂的作用,而不仅仅是作为一种活性调节的生长因子。
在儿童和成人胶质瘤中,谷氨酸能神经元到胶质瘤突触是由钙渗透性AMPARs介导的,并能有效调节胶质瘤的进展。在健康的大脑中,BDNF-TrkB信号通过多个机制调节谷氨酸能突触传递。接着作者探索了BDNF-TrkB信号在胶质瘤中的促生长作用是否涉及突触生物学调节。结果发现,药物阻断AMPARs或通过敲除NTRK2基因阻断TrkB可降低体内或神经元-胶质瘤共培养中肿瘤细胞的增殖(图1j-m)。然而,没有发现阻断AMPARs和TrkB的叠加效应,这表明两者之间存在机制相关性。
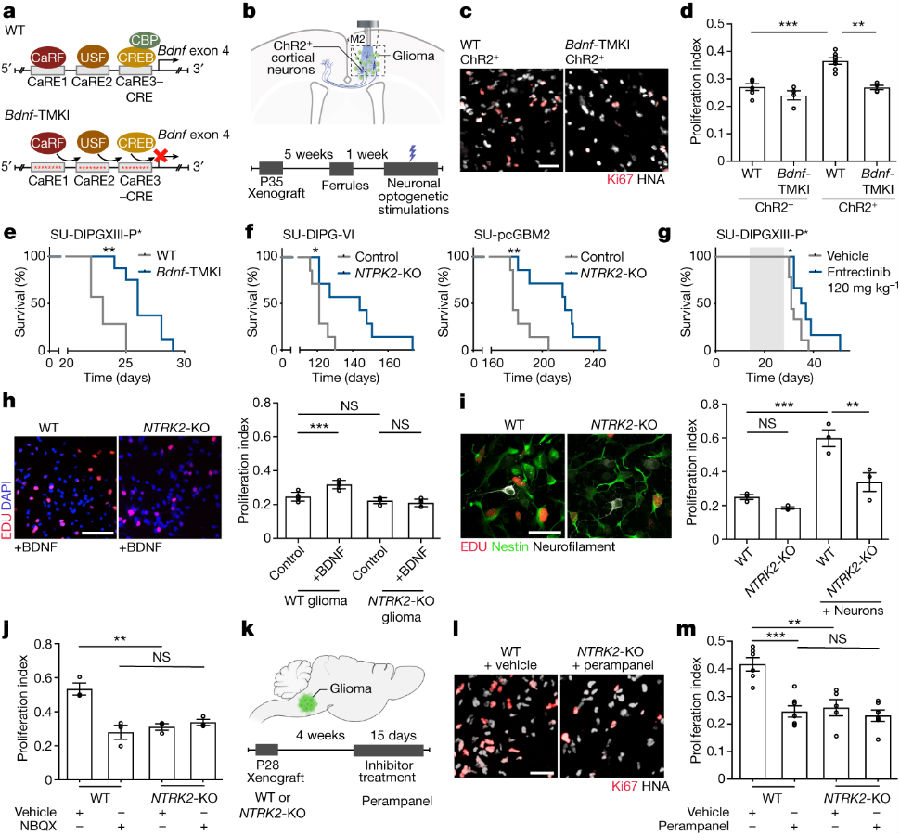
图1. 神经活动调节的BDNF促进胶质瘤进展
(图片源自《Nature》)
研究者在急性切片制备中对移植到海马的胶质瘤细胞进行了全细胞膜片钳电生理实验(图2a)。发现在切片上灌注BDNF增加了谷氨酸诱发电流的振幅(图2b,c)。证实胶质瘤细胞TrkB激活介导谷氨酸诱发电流振幅的变化。与NTRK2野生型胶质瘤异种移植细胞相比,NTRK2敲除阻止了BDNF诱导的谷氨酸诱发内向电流振幅的增加(图2b,c),与BDNF通过CAMKII钙信号通路调节突触强度的假设一致,CAMKII抑制剂KN-93阻断了BDNF对胶质瘤谷氨酸能电流振幅的影响,而非活性类似物KN-92则没有(图2d,e)。这些发现表明BDNF-TrkB信号通路调节胶质瘤细胞中谷氨酸诱发电流的强度。
胶质瘤中的谷氨酸能信号传导可以是突触性的,也可以是非突触性的。为了测试BDNF对神经元到胶质瘤突触电流的影响,研究者将轴突传入神经(Schaffer侧枝)刺激到植入胶质瘤细胞的海马CA1区(图2f)。暴露于BDNF后,胶质瘤EPSCs的振幅增加(图2g,h)。这些数据表明,BDNF增加谷氨酸诱发电流的强度。为了探索BDNF诱导的电流放大对细胞内的影响,研究者对表达基因编码钙指示剂GCaMP6s的异种移植胶质瘤细胞进行了原位钙成像(图2i)。如预期所示,局部应用谷氨酸可诱导胶质瘤细胞中的钙瞬变(图2j-l)。在两种不同的儿童胶质瘤患者模型中,BDNF暴露增加了谷氨酸诱发钙瞬变的强度和持续时间(图2i-l)。

图2. BDNF-TrkB信号传导增加了胶质瘤细胞中谷氨酸能电流的振幅
(图片源自《Nature》)
在健康神经元中,BDNF-TrkB信号通过CAMKII钙信号通路增加AMPARs到突触后膜的运输(图3a)。鉴于上述发现表明,BDNF增加了胶质瘤中AMPAR介导的电流和钙瞬态,研究者下一步研究了BDNF对胶质瘤细胞中AMPAR转运到细胞膜的影响。胶质瘤细胞表达AMPAR亚基GluA2、GluA3和GluA4,暴露于BDNF后,细胞膜上这些亚基的水平都增加了。为了研究BDNF对GluA4和GluA3亚基的影响,使用抗体捕获胶质瘤细胞表面蛋白,并探索AMPAR亚基的水平。与BDNF增加AMPAR向胶质瘤细胞膜运输的假设一致,与载体处理的对照胶质瘤细胞相比,BDNF暴露增加了胶质瘤细胞表面AMPAR亚基GluA3和GluA4的水平(图3b-e)。
研究者们还生成了一个氟标记的钙透性异构体(GluA2(Q)) 以检测GluA2亚基的运输情况。他们在胶质瘤细胞中表达了RFP标记的PSD95,以确认GluA2在胶质瘤突触后位点的定位。当亚基的N端从酸性pH值中移动时,荧光蛋白(SEPs)就会发出荧光将囊泡运输到细胞膜外的中性pH值(图3h)。而后他们将表达GluA2(Q)-SEP和PSD95-RFP的胶质瘤细胞暴露于酸性培养基(pH5.5)中发现会淬灭信号,这表明突触后点位的AMPAR荧光信号大部分来自质膜结合的GluA2(图3i,j)。单个光斑的时间过程成像表明,BDNF暴露引起胶质瘤细胞突触后GluA2水平的增加(图3k-m),其时间尺度与GluA3和GluA4运输的增加(图3b-e)和谷氨酸诱发电流的变化一致。总之,这些发现表明,BDNF-trkb信号传导增加了AMPAR亚基到细胞膜的运输,导致了上述谷氨酸诱发电流的增加。
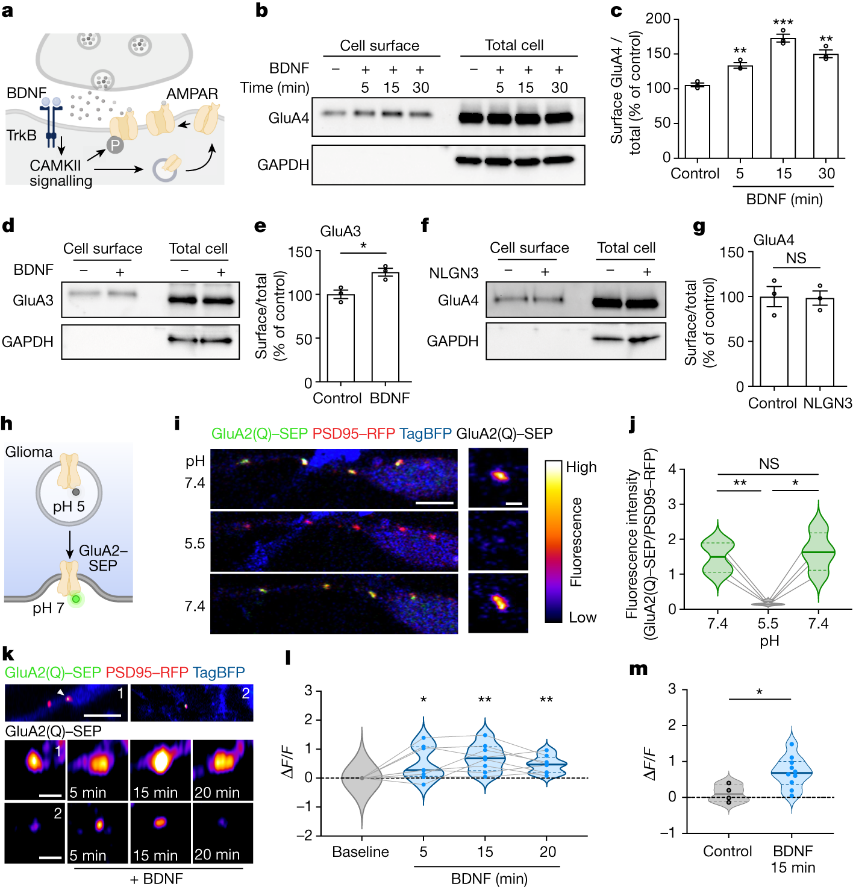
图3. BDNF调节AMPAR到胶质瘤突触后膜的运输
(图片源自《Nature》)
与前人研究结果一致的是,研究者使用膜片钳电生理学观察到异种移植的神经胶质瘤细胞的一个子集表现出向内电流以响应谷氨酸,而NTRK2-KO肿瘤显示对谷氨酸有反应的细胞较少(图4a,b)。研究者先假设胶质瘤细胞中NTRK2的缺失可能会改变恶性突触连通性的程度。为了研究BDNF-TrkB信号是否调节神经元到胶质瘤突触连接的数量,他们对携带表达GFP的野生型和NTRK2-KO患者来源的胶质瘤异种移植小鼠的大脑进行了免疫电镜观察。结果发现NTRK2-KO肿瘤中神经元到胶质瘤的突触结构比野生型肿瘤少(图4c,d)。与神经元的共培养结果显示,同NTRK2野生型胶质瘤细胞相比,NTRK2-KO胶质瘤细胞共培养的突触结构较少,神经元的突触前点与胶质瘤突触后点(PSD95-RFP)共定位(图4e,f)。在神经元-胶质瘤共培养物中添加TrkB抑制剂也可以观察到神经元-胶质瘤突触结构的减少(图4g)。这些数据表明BDNF-TrkB信号调节神经元到胶质瘤的突触连接。
接下来,为了解释突触可塑性在胶质瘤生长中的作用,他们又测试了去极化电流的大小是否会差异促进癌细胞增殖。使用光遗传学策略来模拟不同程度的胶质瘤突触强度,通过对表达蓝光敏感阳离子通道ChR2的患者源性胶质瘤细胞施加不同的蓝光脉冲持续时间(光脉冲宽度)来控制胶质瘤膜-膜去极化的幅度。结果表明,施加5ms或25ms的光脉冲宽度刺激会导致胶质瘤细胞膜的去极化幅度随着光脉冲的持续时间而增加(图4h,i)。表达ChR2的异种胶质瘤移植物体内的去极化显示,随着胶质瘤膜去极化程度的增加,胶质瘤增殖率增加(图4j,k)。综上所述,这些数据将恶性突触可塑性与胶质瘤病理生理联系起来。
总之,这些发现表明BDNF-TrkB信号传导能促进恶性突触可塑性增强从而推动肿瘤进一步发展。这一发现是癌症神经学的重大突破,为脑胶质瘤治疗药物的开发以及突触功能障碍相关疾病的治疗奠定了基础。
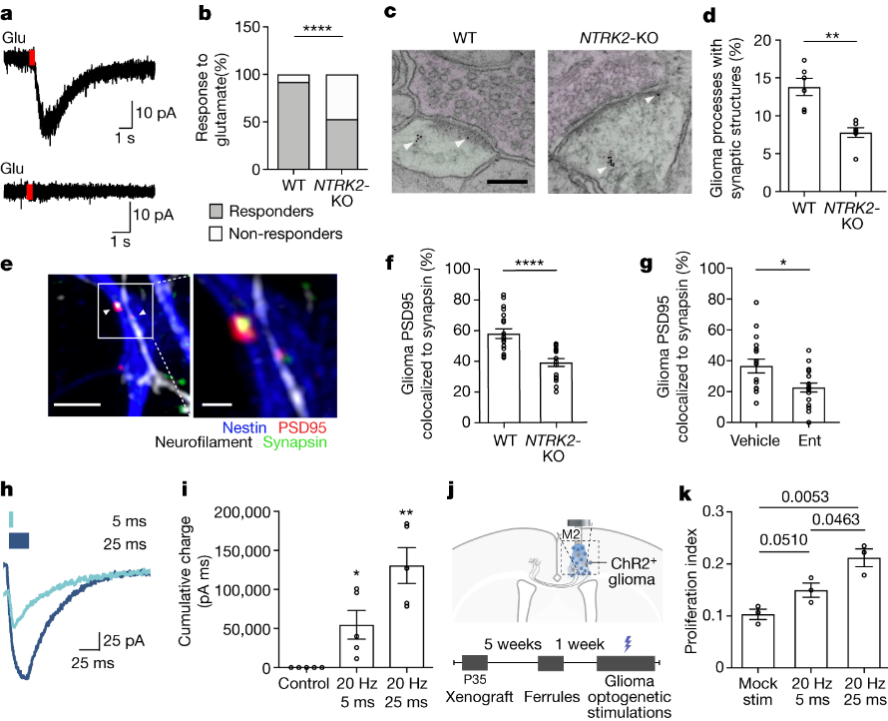
图4. 神经元-胶质瘤连接的可塑性及突触强度增加对肿瘤性能的影响
(图片源自《Nature》)
云克隆开发了上述研究中相关指标的蛋白、抗体、ELISA试剂盒等产品以助力神经肿瘤治疗相关研究,部分指标节选如下,供参考: