铁死亡之父关于铁死亡机制的最新研究
2012年哥伦比亚大学的Brent R. Stockwell教授第一次提出了“铁死亡”的概念,自铁死亡概念提出以来,一直是科学界的研究热点。近期,Brent R. Stockwell教授研究团队针对铁死亡机制的题为“Phospholipids with two polyunsaturated fatty acyl tails promote ferroptosis”的新研究在《Cell》上发表。

含有单个多不饱和脂肪酸酰基尾的磷脂(PL-PUFA1s)被认为是铁死亡的驱动因素,而具有二酰基- PUFA尾的磷脂(PL-PUFA2s)却很少被提及,该研究发现脂肪酸或磷脂处理后,二酰基- PUFA磷脂酰胆碱(PC-PUFA2s)显著聚集,这与癌细胞对铁死亡的敏感性相关。除此之外,PC-PUFA2s的缺失发生在衰老和亨廷顿病脑组织中,与铁死亡有关。值得注意的是,PC-PUFA2s与线粒体电子传递链(mtETC)相互作用产生ROS,启动脂质过氧化。线粒体靶向抗氧化剂保护细胞免受PC-PUFA2s诱导的线粒体ROS(mtROS)、脂质过氧化和细胞死亡。这些发现揭示了PC-PUFA2s在多种情况下控制线粒体稳态和铁死亡中的关键作用,并解释了游离脂肪酸的铁死亡调节机制,PC-PUFA2s可能作为调节铁死亡的诊断和治疗靶点。
1. PC-PUFA2s诱发铁死亡
为研究磷脂调节铁死亡的机制,研究团队向培养基中添加了不同的磷脂(PLs)以明确不同PLs种类对于细胞活性的影响,发现不同的极性头部和脂肪酰基尾对细胞活性的影响:
与磷脂酰乙醇胺(PEs)相比,磷脂酰胆碱(PCs)诱导铁死亡具有更高的效力和特异性,进一步研究发现PC-PUFA2s对于铁死亡的诱导效力比PC-PUFA1s更高。通过添加凋亡、坏死性凋亡、自噬、铁死亡的抑制剂来对死亡类型进行确定,发现仅有铁死亡的抑制剂明显抑制了PC-PUFA2s诱导的细胞死亡。为进一步研究生理情况下PC-PUFA2s在铁死亡中的作用,研究团队使用铁死亡敏感和铁死亡拮抗的细胞系对基线水平的PC-PUFA2进行研究,发现铁死亡敏感细胞系的PC-PUFA2s丰度明显更高。
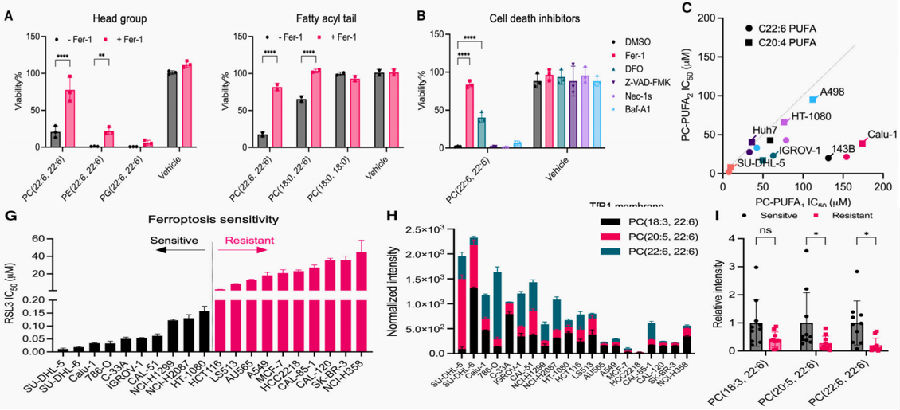
图1. PC-PUFA2s诱发铁死亡
(文中所有图片均源自《Cell》)
2. PC-PUFA2s与mtETC的相互作用
为了阐明介导PL-PUFA2s诱导铁死亡的效应器,研究团队通过Pull-Down实验结合质谱(MS)来鉴定PLs结合蛋白复合物。结果显示,从所有样本中鉴定出大约3500种蛋白,主成分分析显示biotin-PL(22:6,22:6)组与所有其他处理组有明显差异。比较biotin-PL-PUFA2和biotin-PL-PUFA1的火山图分析结果,biotin-PL-PUFA2在pull-down中特异性富集了mtETC复合物I蛋白,通过western blot检测洗脱样品中的ETC复合物蛋白,发现复合物I蛋白仅存于biotin-PL(22:6,22:6)处理的样本中,而复合物III和IV也存于biotin-PL(18:0,22:6)处理的样本中。这些数据表明,线粒体复合物I特别参与了PL-PUFA2s的作用机制。研究团队进一步研究外源PL-PUFA2s在不同细胞器中的分布,通过检测荧光基团结合biotin-PL(22:6,22:6)或PL(18:0,22:6)处理的IGROV-1细胞,发现biotin-PL(22:6,22:6)在线粒体和内质网显著聚集,而不聚集在高尔基体和溶酶体。另外,用亚致死量的PC(22:6,22:6)处理HT-1080细胞,并分离出线粒体。使用LC-MS提取线粒体和其他细胞结构中的脂质并进行分析,发现线粒体和其他细胞结构中均存在PC(22:6,22:6),处理后线粒体中PC(22:6,22:6)的增加较高,线粒体似乎是PC-PUFA2s积累的重要位点。
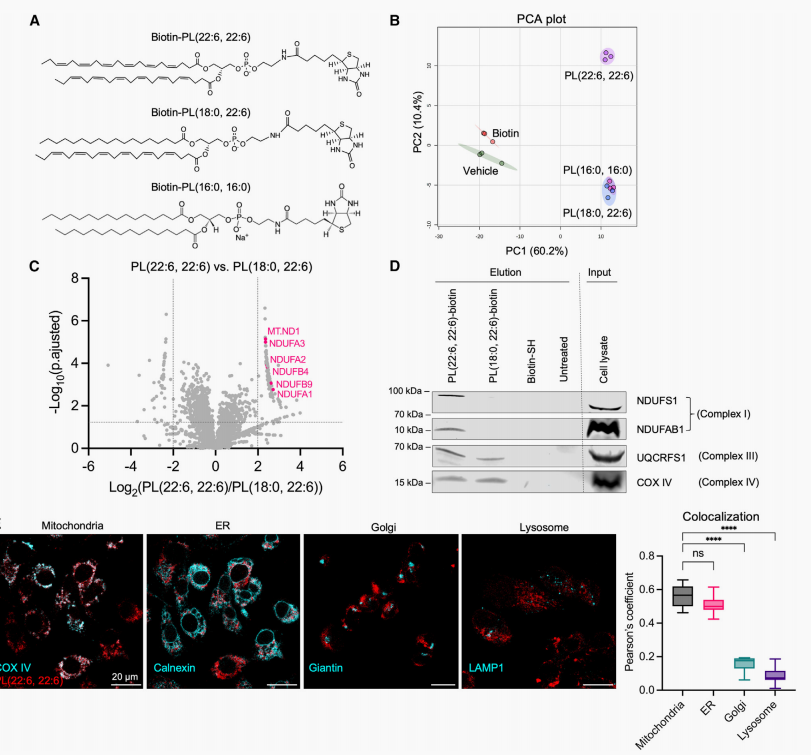
图2. PC-PUFA2s呈现出与mtETC的相互作用
3. PC-PUFA2s诱导线粒体应激
为了研究与PC-PUFA2s积累相关的线粒体应激,研究团队从不同的角度评估线粒体功能,如:线粒体ROS(mtROS)、线粒体膜电位和线粒体氧化磷酸化。通过荧光探针MitoSOX检测发现PC-PUFA2s诱导线粒体超氧化物产生显著增加。据报道,mtETC复合体I产生的ROS促进铁死亡,过量PC-PUFA2s的积累可能会破坏ETC复合体I结构并影响电子传递,导致ROS生成增加。用罗丹明123对线粒体膜电位进行特异性标记发现,与PC-PUFA1s和对照组相比,PC-PUFA2s显著降低了线粒体膜电位。通过测定耗氧率(OCR)来反映线粒体呼吸活动,PC-PUFA2s可显著降低OCR,PC-PUFA2s处理的细胞形态未发射改变说明OCR降低是由于抑制线粒体呼吸而不是细胞活力。线粒体靶向抗氧化剂mitoquinone(MitoQ)可有效减少PC-PUFA2s处理后线粒体超氧化物的积累,MitoQ可以抑制PC-PUFA2s诱导的脂质过氧化。
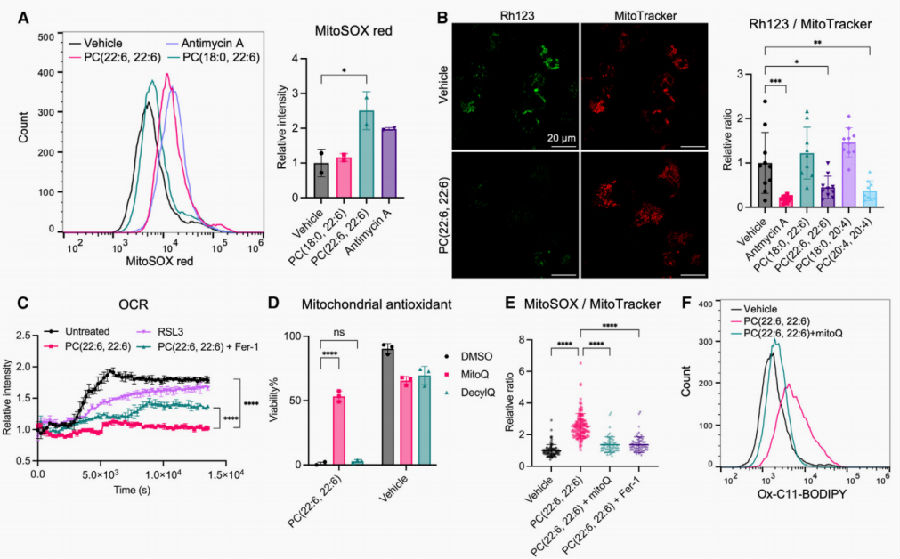
图3. PC-PUFA2s诱导线粒体应激
4. PC-PUFA2s在ER中诱导脂质过氧化,但不诱导UPR
该研究团队之前报道了内质网(ER)是驱动铁死亡脂质过氧化的关键部位。有趣的是,通过用荧光脂质过氧化氢探针Liperfluo和ER-tracker、mito-tracker共染色细胞,观察到PC-PUFA2s处理的细胞中脂质过氧化显著增加,而PC-PUFA1s处理的没有增加,且在ER中增加的更明显,这与之前的研究一致。为了评估PC-PUFA2s处理后的内质网应激,测量了介导内质网未折叠蛋白反应(UPR)的基因表达水平,结果显示这些标志物在PC-PUFA2s处理的细胞中并没有显著变化,说明虽然有脂质过氧化发生,但并未诱导UPR。
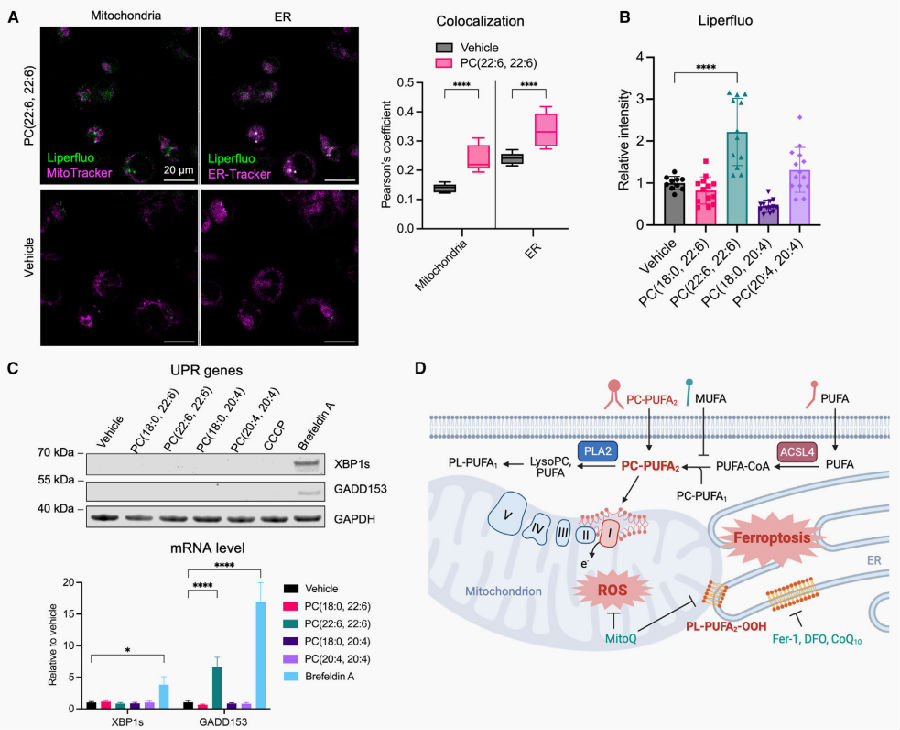
图4. PC-PUFA2s在ER中诱导脂质过氧化,但不诱导UPR
综上所述,PC-PUFA2s是一种重要的促铁死亡脂类,指出了PC-PUFA2s通过独特机制促进细胞死亡的新观点。这些发现不仅增进了我们对铁死亡机制的理解,还为开发针对铁死亡相关疾病的治疗策略提供了新靶点。
云克隆开发了上述研究中涉及到的相关靶标的蛋白、抗体以及试剂盒产品。靶标及核心货号如下,供参考:
靶标 | 核心货号 | 靶标 | 核心货号 |
GPX4 | C994 | ACSL4 | D674 |
CASP3 | A626 | Calnexin | A280 |
LAMP1 | B441 | TFR | B171 |
GCH1 | J057 | NDUFS1 | J794 |
NDUFAB1 | A361 | DDIT3 | J282 |
FASN | C470 |