Nature新发现:炎症信号竟和记忆形成有关?
2024年3月,阿尔伯特-爱因斯坦医学院的研究人员在《 Nature》上发表了题“Formation of memory assemblies through the DNA-sensing TLR9 pathway”的文章,揭示了与记忆形成相关的分子机制,发现记忆形成和DNA损伤及炎症信号相关。
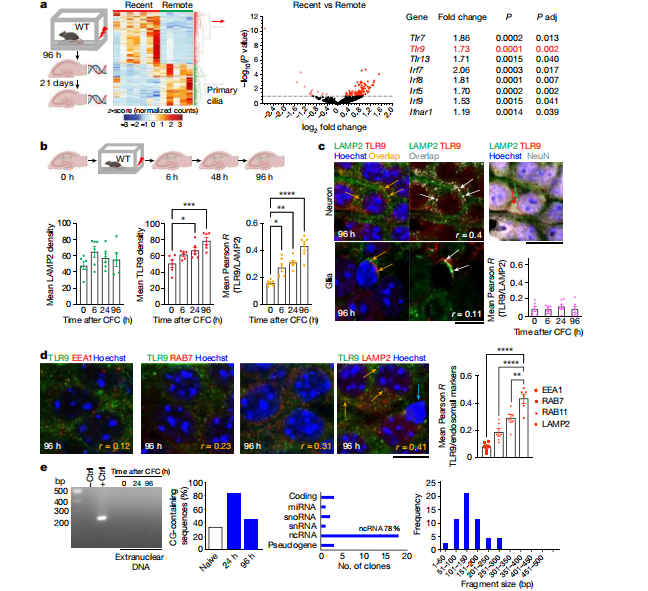
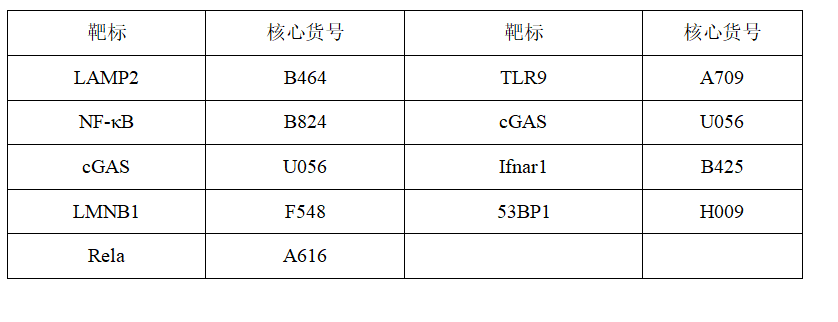
图1. 恐惧情况下的脑部神经元活动
(图片来自《Nature》杂志)
研究团队通过给小鼠进行短暂、温和的电击,形成对电击事件的情境恐惧条件反射(contextual fear conditioning,CFC),并进一步揭示CFC的形成机制。研究人员在电击后24-48h对小鼠的颈背神经元进行转录分析,441个基因的转录水平增加,其中炎症和TLR信号通路相关的基因转录水平增加最为显著。接下来,研究人员通过共定位染色实验发现,囊泡标志物LAMP2蛋白和TLR9蛋白的共同定位增加,揭示TLR9蛋白通过核内体的运输活动增加,这对于DNA的识别和NF-κB的激活有促进作用。TLR9蛋白与cGAS-STING是核外DNA的主要传感器。在无感染或DNA损伤凋亡的情况下,这些通路通常是沉默的;但在神经元应激状态下,TLR9蛋白会对线粒体DNA片段的释放做出反应。为了确定核外是否具有TLR9激活潜能的dsDNA片段,研究人员收集了正常小鼠和经过恐惧训练的小鼠的海马组织,对核外dsDNA片段进行了克隆和测序,和对照组相比,实验组小鼠在CFC之后TLR9的假定激活因子的频率从33%瞬时增加到77%(见图1),证实CFC能显著增加TLR9基因的转录和表达。研究者还使用检测dsDNA或线粒体DNA的染料对原代海马神经元培养物进行了活细胞成像,以区分非线粒体和线粒体核外DNA,发现核外非线粒体移动DNA信号水平增加。
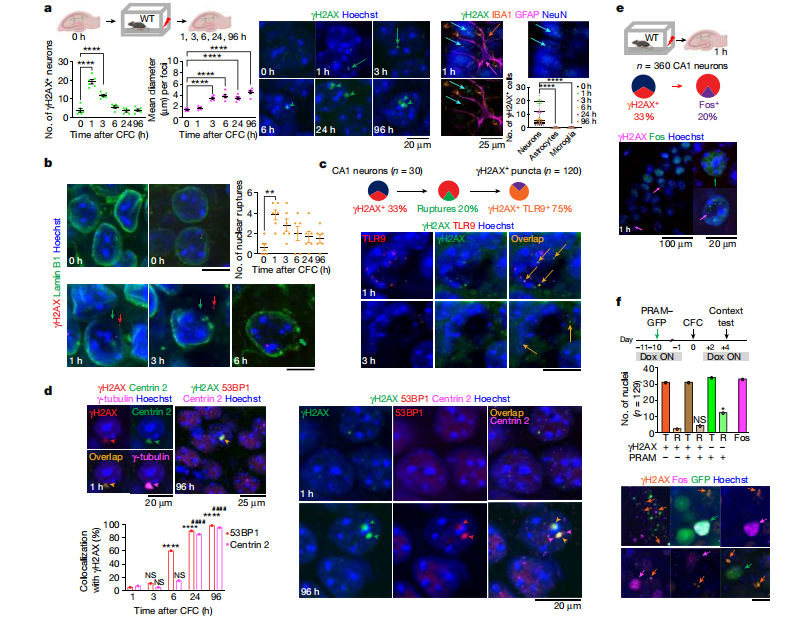
图2. CFC后小鼠神经元的DNA损伤和损伤后修复
(图片来自《Nature》杂志)
已有研究证实,神经元活动可以诱导短暂的DNA断裂。但是这种断裂发生在编码基因的增强子中,并在数分钟内得到修复,不会影响神经元的稳态。为了研究CFC产生的核外dsDNA片段的来源,研究人员使用荧光信号标记dsDNA断裂结合磷酸组蛋白(γH2AX3),并使用图谱或颗粒分析对信号进行量化。结果显示,在CFC发生数小时后,CA1核团中具有明显γH2AX病灶的神经元总数显著增加。虽然核病灶的数量随后减少,但单个神经元中出现了更大的γH2AX标记病灶,并持续了6-96h。而标记γH2AX蛋白的荧光信号在星形胶质细胞或小胶质细胞中均未发现。与核包膜层黏连蛋白B1(LMNB1)的共标记检测显示,在检测到最大dsDNA断裂时,一部分细胞核出现包膜破裂,同时在内质网RNA富集区观察到γH2AX蛋白信号,内质网是非活性TLR9的主要定位点。CFC发生1h后,核包膜破裂数量明显增加。核周γH2AX信号与TLR9共定位标记发现,在某些神经元中,γH2AX和dsDNA单独或以复合物的形式从含有TLR9的核周部位的细胞核中释放出来。在较晚的时间点(6-96h)发现的持续γH2AX信号直径为4µm或更大,并与中心体标记物γ-微管蛋白共定位,这表明γH2AX定位在中心体周围,而不是dsDNA断裂处(见图2)。中心体是一种存在于大多数动物细胞的细胞质中的一种细胞器,对于协调细胞分裂至关重要。但在不分裂的神经元中,受刺激的中心体参与了DNA修复周期,将单个神经元组织成记忆群体。这表明所提出的中心体在分裂细胞中维持基因完整性的作用也适用于进行记忆相关活动的成体神经元。
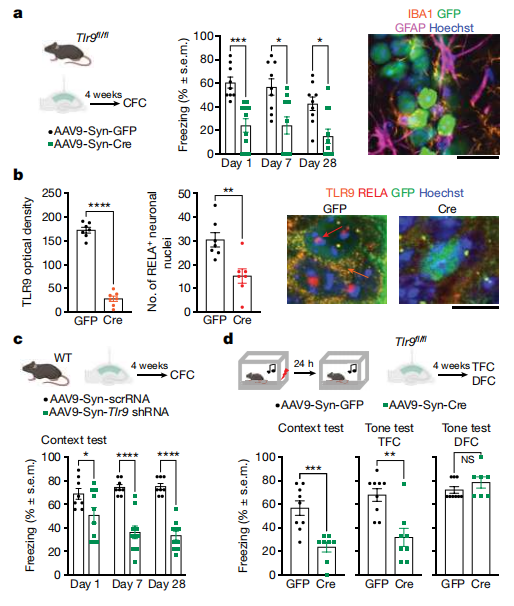
图3. 海马细胞TLR9基因缺失导致情景记忆受损
(图片来自《Nature》杂志)
为了进一步明确炎症是学习记忆的副作用还是有助于记忆的形成,研究人员构建了敲除TLR9的神经元细胞系,通过局部注射的方式诱导小鼠CA1背海马神经元TLR9基因缺失。和正常小鼠相比,TLR9基因缺失小鼠在多次测试中的冻结行为(freezing behaviour)显著减少,这表明小鼠的情境记忆受损。在野生型小鼠的海马中注射表达降低TLR9表达的shRNA,也能复制上述实验的记忆缺失。由于病毒注射会引起星形胶质细胞和小胶质细胞的炎症反应,为了排除这一因素的影响,研究人员注射敲除TLR9的星形胶质细胞后未发现小鼠CFC受到影响。小鼠使用TLR9拮抗剂后也出现相似的冻结行为,表明失去TLR9基因会妨碍长期记忆的形成(图3)。
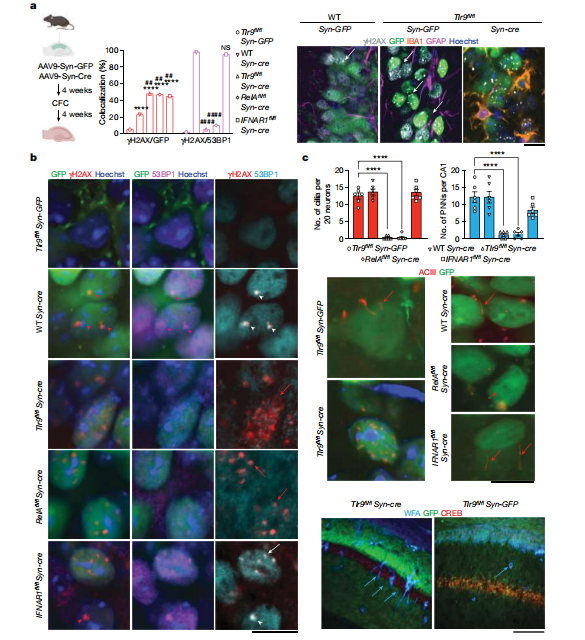
图4. 海马神经元细胞TLR9基因缺失影响DDR,损害神经元纤毛形成
(图片来自《Nature》杂志)
为了明确TLR9基因缺失在细胞层面产生的影响,研究人员使用相同遗传品系的小鼠,通过局部注射的方式分别诱导小鼠CA1背海马神经元TLR9基因,Rela基因缺失,Ifnar1基因缺失,并收集他们的海马细胞。和对照组相比,基因敲除小鼠海马组织dsDNA断裂的神经元数量显著增加。值得注意的是,TLR9和Rela基因的缺失几乎完全破坏了53BP1蛋白向DNA损伤位点的募集,也阻止了53BP1蛋白向位于中心体内的DNA损伤修复位点的移动,提示TLR9信号在维持神经元基因组稳定性中的重要作用。海马组织染色结果显示,TLR9和Rela基因的缺失抑制了CA1神经元中的纤毛形成,并伴随着周围神经元网络(PNNs)的消失和复杂性的下降。鉴于PNNs在稳定记忆回路中的重要性,这表明TLR9缺失可能导致核内和中心体的DNA损伤反应受损,致使CFC刺激后的CA1神经元无法正确召集DNA修复复合物,也无法形成纤毛和PNNs(图4)。
综上所述,神经元细胞中TLR9信号的缺失会导致DNA损伤,影响DNA修复,并抑制神经元纤毛的形成,还能破坏基因组的稳定性,防止小鼠形成长期记忆。因此,维护TLR9信号通路的完整性,可能是一种有前途的神经认知缺陷的预防策略。
云克隆公司助力记忆形成机制研究,为广大科研人员提供相关检测试剂产品。相关靶标核心货号如下: