双刃剑:肥胖诱导巨噬细胞PD-1抑制抗肿瘤免疫
肥胖是许多癌症浸润和转移的危险因素之一,但在某些情况下却可以提高生存率和对免疫检查点阻断疗法的反应,这被称为肥胖悖论。虽然肥胖会促进慢性炎症,但免疫系统在肥胖与癌症关系和免疫治疗中的作用仍不清楚。2024年6月,《Nature》杂志上发表了一篇题为“Obesity induces PD-1 on macrophages to suppress anti-tumour immunity”的文章,在这项研究中,研究者发现肥胖选择性地诱导肿瘤相关巨噬细胞(TAMs)上的程序性死亡受体1(PD-1)表达,进而驱动TAMs特异性反馈机制,减少肿瘤免疫监视,这可能会增加癌症风险,但可以增加肥胖患者对PD-1免疫治疗的反应。

为了证明饮食性肥胖(DIO)可以改变肿瘤的免疫环境,研究者使用肿瘤模型检测DIO对肿瘤生长的影响以及抗PD-1免疫检查点阻断的功效。发现高脂饮食(HFD)喂食的小鼠体重显著增加并表现出包括高血糖和高胰岛素血症在内的肥胖相关代谢变化,注射癌细胞后,HFD的小鼠肿瘤生长速度比喂食低脂饮食(LFD)的小鼠更快,用抗PD-1处理发现高脂饮食(HFD)组小鼠的肿瘤重量的显著减少,这些数据证明HFD可以促进肿瘤生长,并展示了抗PD-1处理后的反应。然后,研究者从肿瘤中分离出CD45+和CD45−细胞,进行单细胞RNA测序(scRNA-seq),单独的HFD处理并没有影响CD45−上皮细胞或成纤维细胞相对丰度的显著变化。然而,抗PD-1处理导致细胞从上皮细胞转变为成纤维细胞,这可能反映了癌细胞的消除。相比之下,CD45+分数显示了HFD组肿瘤免疫细胞数量的显着变化。根据scRNA-seq,HFD处理小鼠的CD8+ TILs(肿瘤浸润淋巴细胞),效应分子的表达水平降低,Gzmb表达水平降低,Havcr2(TIM3)和Lag3共抑制受体表达水平降低。(见图1)
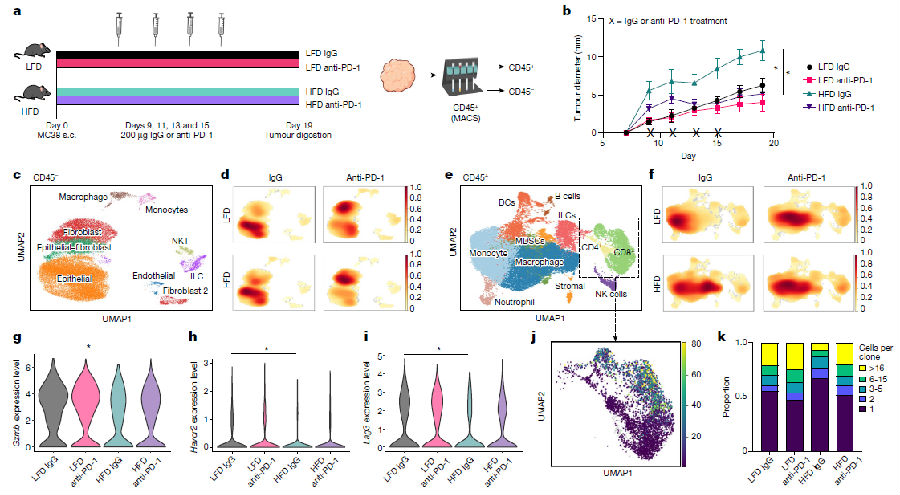
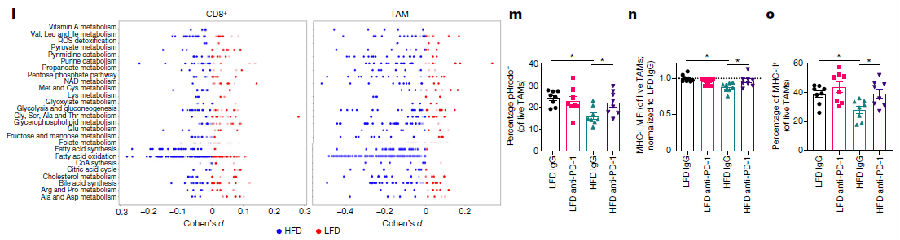
图1 肥胖损害抗肿瘤免疫细胞功能和代谢特征
(图片来源于《Nature》杂志)
研究人员发现,在体重减轻10%前后人子宫内膜肿瘤活检的免疫组织化学染色显示,表达PD-1的TAMs丰度显著降低,虽然表达PD-1的CD8+ T细胞没有变化,但HFD增加了PD-1+ TAMs的比例。与LFD小鼠相比,非肿瘤和荷瘤HFD小鼠脂肪组织巨噬细胞中PD-1的表达水平选择性增加,而骨髓和脾脏则不受影响。这些数据支持一种模型,即肥胖、代谢紊乱和炎症直接驱动巨噬细胞PD-1的表达。除了脂多糖(LPS)外,促炎和肥胖相关的细胞因子和脂肪因子,包括干扰素γ(IFNγ)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、肿瘤坏死因子(TNF)、瘦素和胰岛素,都增加了骨髓巨噬细胞上PD-1的表达水平。肥胖还会增加循环游离脂肪酸的水平,而用饱和脂肪酸棕榈酸C16:0处理,会导致与PD-1表达增加呈负相关的剂量反应毒性。虽然之前已经确定TAMs可以表达PD-1,PD-1与吞噬功能呈负相关,但现在的数据表明,HFD介导的肥胖可诱导TAMs中PD-1的表达,这可能是由于肥胖相关的炎症细胞因子、瘦素、胰岛素和游离脂肪酸的增加。(见图2)
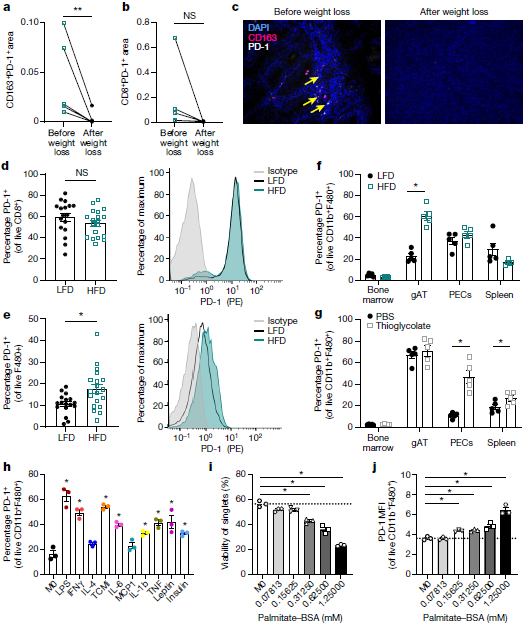
图2 肥胖和肥胖相关信号驱动巨噬细胞特异性PD-1。
(图片来源于《Nature》杂志)
scRNA-seq数据显示,原癌基因(MYC)和雷帕霉素靶蛋白C1(mTORC1)信号通路上PD-1+ TAMs细胞富集,而IL-6、TGF-β和TNF信号通路在PD-1− TAMs中占主导地位。流式细胞术对MC38肿瘤的PD-1+和PD-1low/− TAMs进行检测,证实PD-1+ TAMs的线粒体质量增加,脂质摄取水平增加,吞噬水平降低和主要组织相容性复合体II类分子(MHC-II)表达水平降低,这些数据说明PD-1是巨噬细胞代谢和功能的调节因子。在体外,研究者发现LPS有效地增加了巨噬细胞mTORC1下游pS6的表达,抑制MYC、NF-κB或mTORC1可降低LPS处理的骨髓巨噬细胞(BMDMs)、RAW264.7细胞中PD-1的表达。为了从基因上检测mTORC1的作用,使用CRISPR敲除Pten并激活BMDMs中的PI3K-mTORC1通路,发现PTEN缺陷细胞PD-1表达增加。当葡萄糖类似物2-脱氧葡萄糖(2-DG)抑制糖酵解时,M1样刺激的BMDMs中PD-1的表达水平降低,但不受谷氨酰胺解或脂质氧化抑制的影响。(见图3)

图3 PD-1介导的巨噬细胞功能障碍依赖于mTOR和MYC的激活。
(图片来源于《Nature》杂志)
研究者用细胞程序性死亡配体1(PD-L1)或抗PD-1阻断抗体处理野生型BMDMs,虽然耗氧量没有变化,饱和表达PD-1的巨噬细胞中糖酵解水平降低,脂质摄取增加,并且这些表型被PD-1阻断抗体逆转。与IgG处理相比,阻断PD-1可提高MC38 TAMs中吞噬和诱导型一氧化氮合酶(iNOS)、GLUT1、CD80、MHC-I和MHC-II的表达水平。RNA-seq显示,PD-1阻断分离的TAMs导致广泛的炎症和代谢基因变化。阻断PD-1的促炎作用依赖于糖酵解水平的增加,用2-DG处理可以防止抗PD-1处理的BMDMs中MHC-II、MHC-I和CD80的表达。综上所述,这些数据表明,通过mTORC1诱导PD-1表达可以激活糖酵解的炎症信号,PD-1抑制巨噬细胞糖酵解和炎症功能,转而促进脂质摄取和代谢。(见图4)
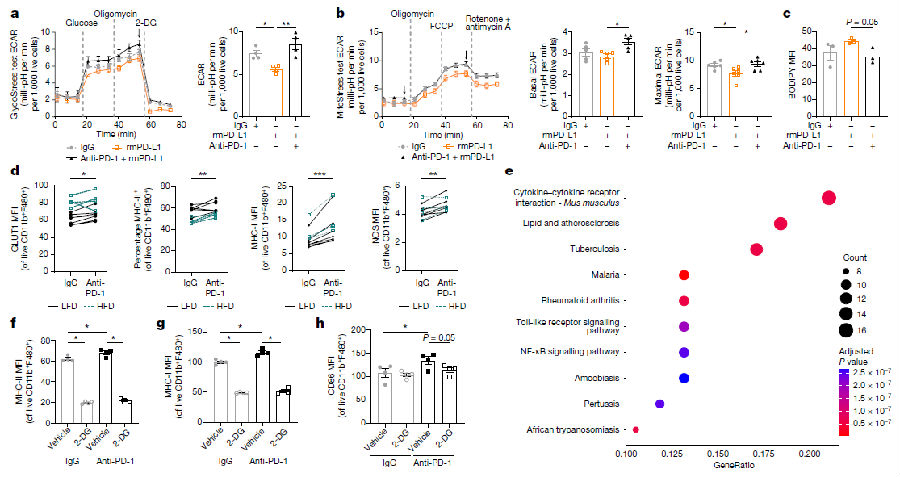
图4 抗PD-1直接恢复巨噬细胞的抗肿瘤功能和代谢
(图片来源于《Nature》杂志)
接着,研究人员发现T细胞耗尽的肿瘤表现出更高的生长水平,但仍对抗PD-1处理有反应。在T细胞枯竭的肿瘤微环境中,TAMs通过增加吞噬水平、减少脂质摄取和增加葡萄糖转运蛋白GLUT1的趋势对抗PD-1处理做出反应。PD-1缺失的骨髓细胞有效地降低了肿瘤生长。与野生型TAMs相比,PD-1缺陷的肿瘤CD11b+骨髓细胞吞噬作用增强,脂质摄取水平降低,代谢活性增加,表明合成代谢增加,抗原呈递和激活T细胞的能力提高。PD-1、LAG3和TIM3共抑制标志物的表达水平降低,而CD69的表达水平不变。因此,PD-1为巨噬细胞的糖酵解代谢和功能提供了由炎症引起的直接反馈,以调节抗肿瘤免疫反应,而这一途径在肥胖中得到增强。(见图5)
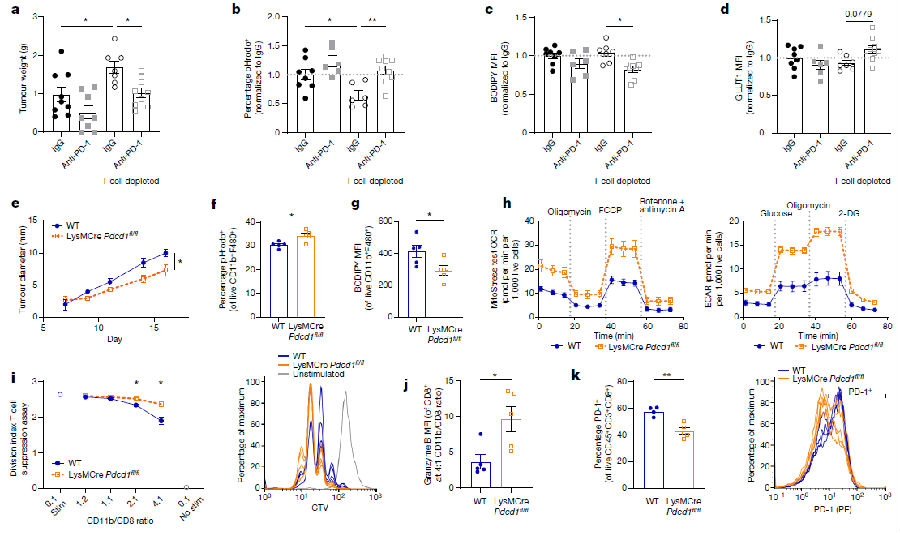
图5 靶向巨噬细胞特异性PD-1提高T细胞介导的抗肿瘤免疫
(图片来源于《Nature》杂志)
总的来说,这些研究结果揭示了肥胖与癌症之间的联系,将PD-1确定为TAMs的代谢调节因子,并揭示了一种独特的PD-1介导的巨噬细胞特异性免疫肿瘤监测和检查点阻断机制。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 核心货号 |
PD-1 | A751 | NKp46 | B800 |
CD86 | A824 | CD3d | B872 |
CD163 | B726 | CD3g | D118 |
TREM2 | G628 | CD206 | B542 |
CD8A | B099 | GLUT1 | B185 |
FOXP3 | B877 | LAG3 | B663 |
CD4 | B167 | TIM3 | H930 |
更多信息,欢迎访问http://www.cloud-clone.com/。