突破卵巢癌治疗瓶颈:揭秘细胞外信号与化疗耐药性的关联
卵巢癌是妇科中死亡率较高的恶性肿瘤。在大多数情况下,卵巢癌是通过铂类化疗来控制的,但它们不可避免地会产生耐药性,导致复发。长期以来,在治疗过程中获得耐药性一直被视为一个完全局限于癌细胞内发生的分子事件的过程。然而,最近的数据表明初始治疗诱导的癌细胞死亡促进了存活克隆的后续扩增。在化疗期间,垂死的肿瘤细胞成为肿瘤微环境的组成部分,释放出刺激剩余癌细胞增殖的分子。这种现象确保了初始治疗反应后肿瘤快速重新增殖,在医学实践中已得到认可,但在分子水平上研究甚少。了解这些细胞外信号网络的性质并开发抑制它们的方法可以揭示肿瘤细胞适应治疗背后的机制,并提高标准化疗的疗效。
2024年6月19日,俄罗斯联邦医学生物局Lopukhin联邦物理化学医学研究和临床中心Victoria O. Shender团队在《Nature Communications》上发表题为“Therapy-induced secretion of spliceosomal components mediates pro-survival crosstalk between ovarian cancer cells”的文章,他们对离体和体外化疗诱导的卵巢癌细胞分泌组的变化进行了全面分析,揭示了一种有助于在癌细胞中获得治疗耐药性的分子机制。

在这篇文章中,云克隆抗体【核纤层蛋白B1(LMNB1)多克隆抗体,PAF548Hu01;微管蛋白β(TUBb)多克隆抗体,PAB870Hu01】受到科研工作者的认可,荣登优秀国际期刊。

在这项研究中,作者对离体和体外化疗诱导的卵巢癌细胞分泌组的变化进行了全面分析,发现卵巢癌症细胞在治疗时分泌的分子促进了受体癌症细胞的顺铂耐药性并增强了DNA损伤修复。即使是化疗诱导的分泌体与化疗诱导的癌症卵巢细胞的短期孵育也会诱导类似于长期治疗后在化疗耐药性患者来源的肿瘤细胞中观察到的变化。使用综合组学技术,他们发现离体和体外治疗诱导的分泌体都富含剪接体成分,剪接体成分在治疗后从细胞核重新定位到细胞质,随后进入细胞外囊泡。他们证明这些分子对治疗诱导的分泌组的表型效应有重大贡献。SNU13和SYNCRIP剪接体蛋白促进治疗耐药性,而外源性U12和U6atac snRNAs刺激肿瘤生长。
总之,这项研究强调了细胞外信号在获得卵巢癌治疗耐药性方面的重要性,揭示了化疗耐药的潜在机制。这些发现为潜在的治疗策略铺平了道路。靶向剪接体成分可以增强DNA损伤药物的疗效,减少治疗耐药性的获得,并最终提高卵巢癌患者的预后。
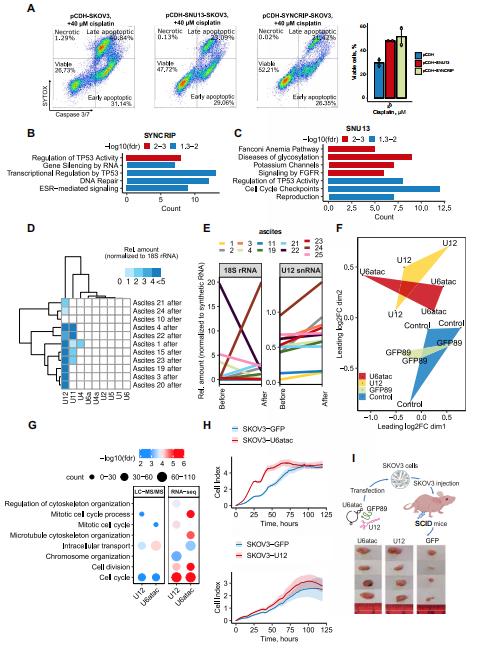
图 细胞外剪接体成分有助于卵巢癌的侵袭性