糖尿病性心肌病:隐藏在血糖背后的心脏危机
糖尿病性心肌病(DCM)是一种特殊形式的心脏病,由对心脏组织中胰岛素代谢作用的抵抗、代偿性高胰岛素血症和高血糖的进展引起,其发生独立于其他心脏风险因素,如冠状动脉疾病和高血压。这种形式的心肌病是发达国家发病率和死亡率的主要原因,其患病率随着肥胖和2型糖尿病发病率的增加而上升。在胰岛素抵抗或高胰岛素血症状态下观察到的DCM的特征是心肌胰岛素信号受损、线粒体功能障碍、内质网应激、钙稳态受损、冠状动脉微循环异常、交感神经系统激活、肾素-血管紧张素-醛固酮系统激活和适应不良免疫反应。这些病理生理变化导致氧化应激、纤维化、肥大、心脏舒张功能障碍,最终导致收缩性心力衰竭。因此,预防糖尿病心脏代谢紊乱的有效策略可能为DCM提供新的治疗选择。
1. 抑制新型Dickkopf-1-LDL受体相关蛋白5和6轴预防小鼠DCM
抗高血压药物是世界上使用最频繁的药物之一。然而,对于糖尿病高血压患者,尚无有效的降压策略。Wnt共受体LDL受体相关蛋白5和6(LRP5/6)可以直接与几种G蛋白偶联受体(GPCR)结合。基于血管紧张素II 1型受体(AT1R)是调节高血压最重要的GPCR,福建中医药大学中西医结合研究院Weidong Zhu团队探讨了LRP5/6及其结合蛋白Dickkopf-1(DKK1)与AT1R激活之间可能的机制联系,并进一步假设LRP5/6-GCR相互作用可能影响高血压并在糖尿病情况下加重心脏损伤[1]。他们发现人类血压上调与血清DKK1升高呈正相关。LRP5/6在物理和功能上与AT1R相互作用。由注射重组DKK1蛋白或条件性LRP5/6缺失引起的膜LRP5/6的缺失导致AT1R活化和高血压,以及β-抑制蛋白1活化和心脏损伤(图1),可能是因为多重GPCR改变。此外,给予抗DKK1中和抗体有效地预防了小鼠的糖尿病心脏损伤。这项研究提示监测和治疗性消除血液DKK1可能是减轻糖尿病损伤的一种有前途的策略。
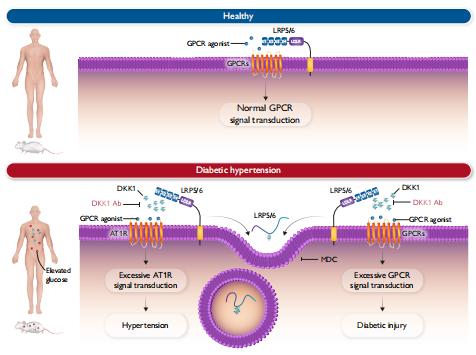
图1 DKK1在糖尿病中诱导高血压和器官损伤发展中的作用
2. TGR5抑制脂肪酸摄取预防DCM
糖尿病性心肌病的特点是心肌脂质蓄积和心功能不全。胆汁酸代谢在心血管和代谢性疾病中起着至关重要的作用。TGR5是一种主要的胆汁酸受体,与代谢调节和心肌保护有关。然而,胆汁酸-TGR5通路在维持心脏代谢稳态中的确切作用尚不清楚。北京大学心血管受体研究重点实验室Ming Xu团队发现患有糖尿病心肌损伤的男性和女性参与者的血浆胆汁酸水平都有所下降[2]。此外,在接受高脂肪饮食和链脲佐菌素治疗或在糖尿病遗传背景下饲养的心肌细胞特异性TGR5缺失小鼠中,心肌脂质积聚和心功能障碍增加。进一步的研究表明,TGR5缺失增强了心脏脂肪酸的摄取,导致脂质积聚。从机制上讲,TGR5缺失通过棕榈酰酰基转移酶DHHC4介导的CD36棕榈酰化的上调促进CD36在质膜上的定位(图2)。这项研究表明,TGR5-DHHC4途径调节心脏脂肪酸摄取,突出了靶向TGR5在DCM治疗中的潜力。

图2 TGR5通过DHHC4抑制CD36棕榈酰化
3. USP28是糖尿病心脏线粒体形态功能缺陷和心脏功能障碍的关键抑制因子
大多数糖尿病患者易患心功能障碍和心力衰竭,传统药物治疗无法纠正DCM的进展。武汉大学人民医院心内科Qi-zhu Tang团队评估了USP28(泛素特异性蛋白酶28)在DCM中的潜在作用和治疗价值[3]。基于糖尿病小鼠和糖尿病患者心脏的UPS(泛素蛋白酶体系统)的微阵列分析表明,心室的USP28表达显著降低。与对照组相比,糖尿病Myh6-Cre+/USP28fl/fl小鼠表现出更严重的进行性心脏功能障碍、脂质积聚和线粒体紊乱。USP28过表达改善了糖尿病心脏的收缩和舒张功能障碍,并改善了心脏肥大和纤维化。AAV9-USP28糖尿病小鼠在心脏组织中的脂质储存、活性氧形成减少和线粒体损伤也比对照糖尿病小鼠表现出更少。USP28过表达减轻了高脂饮食/链脲佐菌素诱导的2型糖尿病小鼠的心脏重塑和功能障碍、脂质积聚和线粒体损伤。机制分析显示,USP28直接与PPARα相互作用,去泛素化和稳定PPARα,以促进Mfn2转录,从而阻止线粒体形态功能缺陷(图3)。在PPARα缺失和Mfn2功能条件性丧失的小鼠中,USP28的这种心脏保护作用在很大程度上被消除。
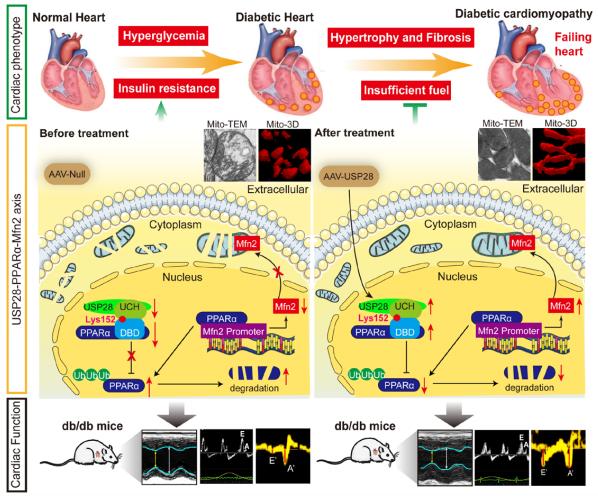
图3 USP28是糖尿病心脏线粒体形态功能缺陷和心脏功能障碍的关键抑制因子
4. AGO2通过激活线粒体基因翻译对DCM的保护作用
MicroRNAs转运到亚细胞细胞器中以修饰DCM相关基因。然而,作为miRNA调节机制的核心成员,亚细胞AGO2在DCM中的作用仍然难以捉摸。华中科技大学同济医学院同济医院内科心内科Dao Wen Wang团队探讨亚细胞定位AGO2在糖尿病和DCM小鼠模型上的作用和机制[4]。糖尿病心肌细胞线粒体AGO2含量降低。线粒体AGO2的过度表达减轻了糖尿病诱导的心功能障碍。AGO2募集了一种线粒体翻译延伸因子TUFM,以激活电子传输链亚基CYTB的翻译并减少活性氧(图4)。丙二酰化是AGO2的一种翻译后修饰,减少了糖尿病心肌病中AGO2向线粒体的输入。进一步分析表明,AGO2丙二酰化由SIRT3的细胞质定位短亚型通过先前未知的去甲酰胺酶功能调节。这些研究结果表明,SIRT3–AGO2–CYTB轴将糖毒性与心脏电子传输链失衡联系起来,为开发DCM的线粒体靶向疗法提供了新的机制见解和基础。
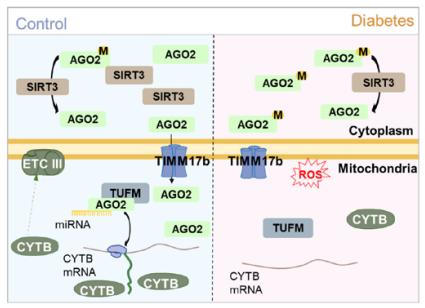
图4 线粒体AGO2在DCM中保护作用
参考文献
[1]Ma E, Wo D, Chen J, et al. Inhibition of a novel Dickkopf-1-LDL receptor-related proteins 5 and 6 axis prevents diabetic cardiomyopathy in mice [J]. Eur Heart J. 2024;45(9):688-703. (IF=39.3)
[2]Wang H, Wang J, Cui H, et al. Inhibition of fatty acid uptake by TGR5 prevents diabetic cardiomyopathy [J]. Nat Metab. Published online May 2, 2024. doi:10.1038/s42255-024-01036-5. (IF=20.8)
[3]Xie SY, Liu SQ, Zhang T, et al. USP28 Serves as a Key Suppressor of Mitochondrial Morphofunctional Defects and Cardiac Dysfunction in the Diabetic Heart [J]. Circulation. 2024;149(9):684-706. (IF=37.8)
[4]Zhan J, Jin K, Xie R, et al. AGO2 Protects Against Diabetic Cardiomyopathy by Activating Mitochondrial Gene Translation [J]. Circulation. 2024;149(14):1102-1120. (IF=37.8)
云克隆不仅可提供糖尿病、高尿酸、非酒精性脂肪肝、高血脂、动脉粥样硬化等代谢疾病动物模型,还可提供心肌梗死、心律失常、心肌肥厚、心肌炎、心力衰竭等心血管系统疾病动物模型。此外,我们还具有各类代谢疾病和心血管系统疾病检测指标及上述LRP5/6、DKK1、AT1R、TGR5、Mfn2等相关产品,可助力广大科研工作者进行代谢疾病相关研究。

