细胞凋亡:生理调控与疾病治疗的新视角
细胞凋亡是一个高度调控的细胞死亡过程,是各种生理过程的重要组成部分,包括正常细胞更新、免疫系统的正常发育、激素依赖性萎缩、胚胎发育和化学诱导的细胞死亡。不适当的细胞凋亡是许多人类疾病的一个因素,包括神经退行性疾病、缺血性损伤、自身免疫性疾病和许多类型的癌症。随着细胞凋亡成为研究的焦点,细胞凋亡的巨大治疗潜力使研究人员能够开发出有前途的治疗解决方案,专注于异常细胞的自愿死亡。研究继续集中在阐明和分析控制细胞凋亡的细胞周期机制和信号通路上。尽管已经鉴定出许多关键的凋亡蛋白,但这些蛋白的作用或不作用的分子机制仍有待阐明。近期,多篇文献报道了细胞凋亡机制相关研究,可能为开发新的细胞凋亡相关药物和疗法提供帮助。
1. 细胞凋亡释放硫化氢以抑制Th17细胞分化
细胞凋亡缺陷可促进炎性淋巴细胞分化,加剧免疫紊乱和疾病进展。然而,细胞凋亡缺陷如何导致免疫反应的生理病理过程的细节尚不完全清楚。中山大学口腔医院Songtao Shi团队发现凋亡缺陷的MRL/lpr(B6.MRL-Faslpr/J)和Bim−/−(B6.129S1-Bcl2l11tm1.1Ast/J)小鼠在Th17细胞异常分化的同时,H2S水平显著降低,这可以通过额外的H2S来挽救[1]。此外,凋亡细胞和囊泡表达关键的H2S生成酶,产生大量的H2S,表明凋亡代谢是H2S的重要来源。从机制上讲,H2S巯基化硒蛋白F(Sep15)促进信号转导因子和转录激活因子1(STAT1)磷酸化,抑制STAT3磷酸化,从而抑制Th17细胞分化(图1)。这项研究揭示了凋亡在维持H2S稳态中的作用,以及H2S通过Sep15C38的巯基化调节Th17细胞分化的独特作用。
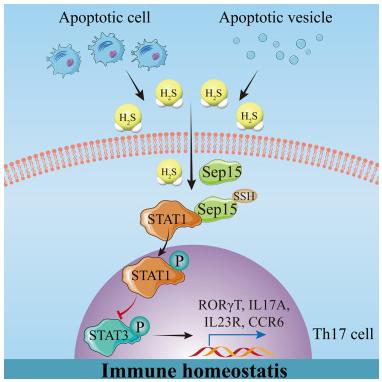
图1 凋亡细胞产生H2S以维持免疫稳态,并通过Sep15C38的巯基化抑制Th17细胞分化
2. DNA损伤通过核糖体停滞诱导p53非依赖性细胞凋亡
为了应对过度的DNA损伤,人类细胞可以激活p53以诱导细胞凋亡。缺乏p53的细胞在DNA损伤后仍可发生凋亡,但其途径尚不清楚。荷兰癌症研究所Thijn R. Brummelkamp团队观察到,响应DNA损伤的p53非依赖性细胞凋亡与翻译抑制相一致,其特征是核糖体在编码UUA密码子的稀有亮氨酸上停滞,并整体减少翻译起始[2]。遗传筛选确定转移RNAse SLFN11和激酶GCN2分别是UUA停滞和全局翻译抑制所需的因子。停滞的核糖体激活了核糖体传感器ZAKα向细胞凋亡机制传递的核糖毒性应激信号(图2)。这些结果为SLFN11在化疗无反应的肿瘤中频繁失活提供了解释,并强调核糖体停滞是影响细胞对DNA损伤命运的信号事件。
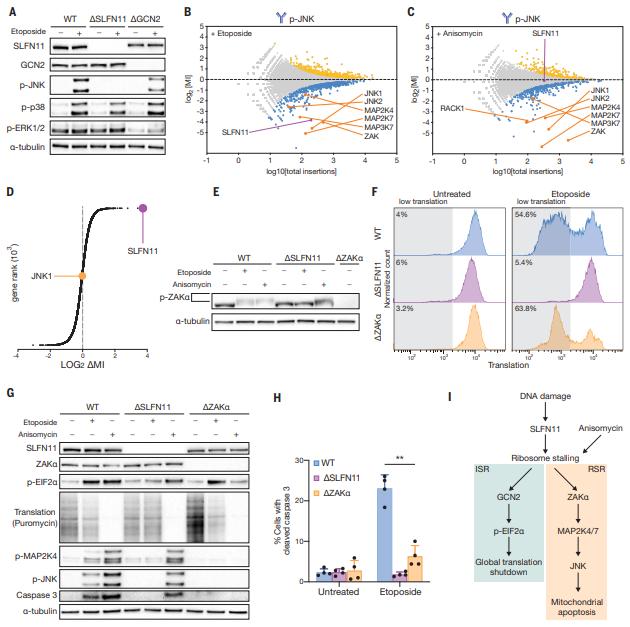
图2 SLFN11诱导的核糖毒性应激激活ZAKa并引起MAPK依赖性细胞凋亡
3. 核糖毒性应激反应驱动紫外线介导的细胞凋亡
虽然紫外线(UV)辐射会损害DNA,引发DNA损伤反应(DDR),但它也会损害RNA,触发转录组范围的核糖体碰撞并引发核糖毒性应激反应(RSR)。然而,这些途径在决定细胞命运中的相对作用、时间和调控尚不清楚。美国约翰斯·霍普金斯大学医学院Rachel Green团队发现紫外线诱导的细胞凋亡是由RSR激酶ZAK介导的,而不是通过DDR介导的(图3)[3]。他们发现了两个调节ZAK介导的细胞凋亡的负反馈模块:(1)GCN2激活限制了核糖体碰撞并减弱了ZAK介导的RSR;(2)ZAK活性导致磷酸化蛋白自磷酸化及其随后的降解。这些事件将ZAK的活性调整到碰撞水平,以建立稳态、耐受性和死亡机制,揭示了其作为核酸损伤的细胞哨兵的关键作用。
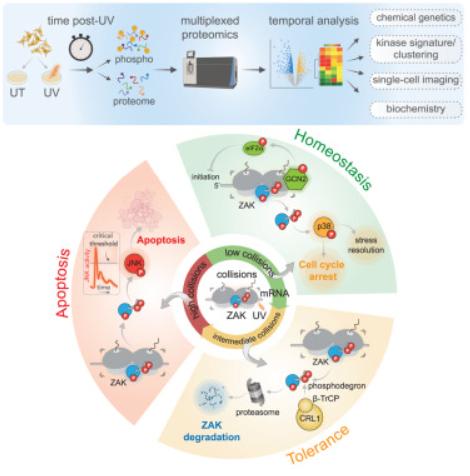
图3 核糖毒性应激反应介导紫外线依赖性程序性细胞死亡
云克隆不仅可提供多种细胞死亡(凋亡、自噬、铁死亡、焦亡)信号通路相关产品,包括TNFα、CASP3、CTSK、NFkB、CASP9、Bcl2、BECN1、CTSD、CTSL、ERK1、ERK2等,还具有上述STAT1、STAT3、p53、GCN2等相关蛋白检测产品,可助力广大科研工作者进行细胞死亡相关研究。
参考文献
[1]Ou Q, Qiao X, Li Z, et al. Apoptosis releases hydrogen sulfide to inhibit Th17 cell differentiation[J]. Cell Metab. 2024;36(1):78-89.e5. (IF=27.7)
[2]Boon NJ, Oliveira RA, Körner PR, et al. DNA damage induces p53-independent apoptosis through ribosome stalling[J]. Science. 2024;384(6697):785-792. (IF=44.7)
[3]Sinha NK, McKenney C, Yeow ZY, et al. The ribotoxic stress response drives UV-mediated cell death[J]. Cell. 2024: S0092-8674(24)00527-0. (IF=45.5)