TRET激活靶向DNA甲基化和多重衰老特征
生物体衰老的特征是生理完整性和适应性的时间依赖性丧失。这一特征是由多种、重机制共同驱动的,通过导致细胞损伤的积累,最终引起器官功能和组织稳态下降。端粒功能障碍是衰老的主要标志,端粒酶逆转录酶(TERT)基因的低转录会引起端粒酶活性不足,从而引发端粒功能障碍和衰老相关疾病。此外,TERT还作为衰老和年龄相关疾病关键基因的转录共调节剂。然而,TERT的下游作用机制仍未得以阐明。最近,美国德克萨斯大学团队在《Cell》上发表了题为“TERT activation targets DNA methylation and multiple aging hallmarks”的文章。研究中,作者鉴定报道了一种TERT激活剂化合物(TAC),该化合物通过MEK/ERK/AP-1级联上调TERT转录。在人的原代细胞和自然衰老高龄小鼠中,TAC诱导的TERT水平升高能促进端粒合成,并能通过减少细胞衰老和炎症细胞因子来减弱组织衰老标志,同时通过上调甲基转移酶DNMT3B介导的启动子超甲基化来沉默衰老标志基因p16INK4a的表达。在人脑中,TAC减轻神经炎症,增加神经营养因子,刺激成年人神经发生,并保持认知功能,而没有明显的毒性,包括癌症风险。总之,这些发现强调了TERT在衰老过程中的关键作用,并为TERT生理激活作为减轻多种衰老特征和相关病理的策略提供了临床前证明。这将会对阿尔茨海默病、帕金森病等年龄相关疾病产生积极治疗意义。
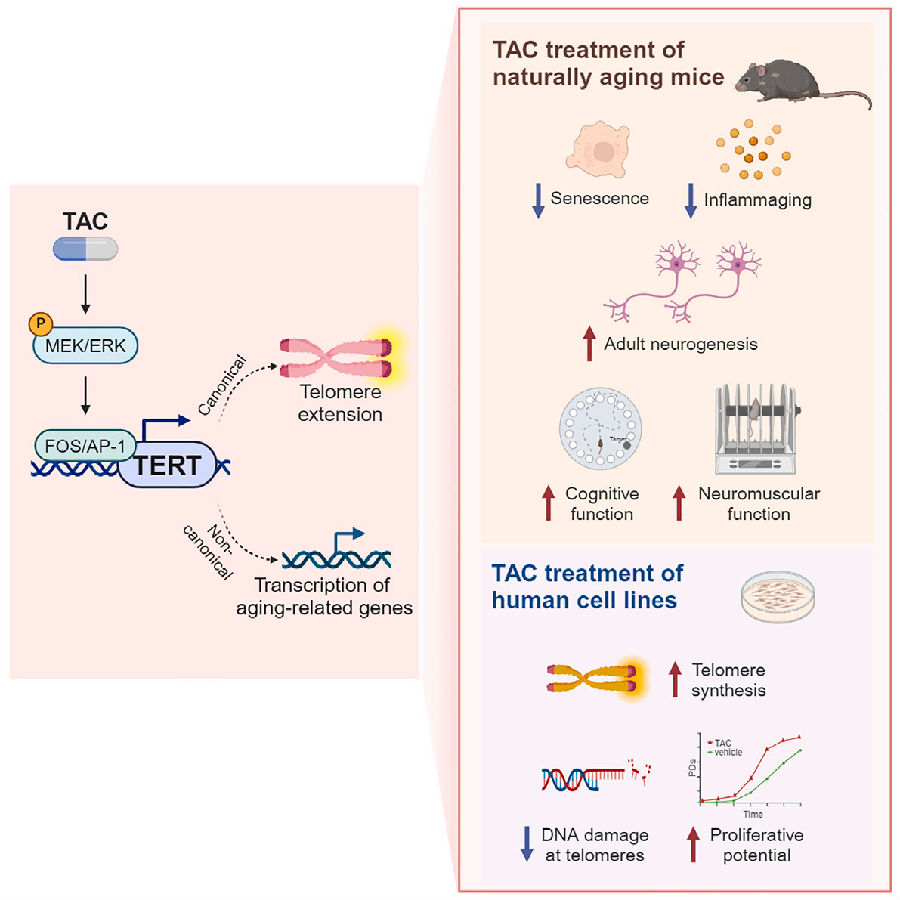
首先,研究者通过基于细胞的高通量筛选(HTS)法,以大规模筛选在成年转基因(hTERT)小鼠耳成纤维细胞中调节人TERT转基因体内转录活性的小分子。最终,通过Rluc荧光素酶报告基因的测量表征了大约100个位点。鉴定出了几种能够诱导TERT基因转录活性的TCAs。免疫印迹分析表明,筛选的TAC能诱导TERT蛋白的最高表达。因此选择它进行进一步的分析。另外,TAC处理能诱导原代人成纤维细胞MRC5中TRET mRNA水平的依赖性升高。一致的是,TAC处理导致TERT基因转录起始位点上游活性增强子/启动子标记H3K27ac的积累和抑制标记H3K9me3的缺失,表明TAC可以覆盖调控人TERT基因座的染色质状态。此外,TAC能增加hTERT-Rluc转基因小鼠的多个组织(包括脑、心脏和骨骼肌)中人类TERT基因的表达。对原发性维尔纳综合症(WS)成纤维细胞中TAC活性的评估结果表明,可以通过强制hTERT的表达来逆转这些细胞的快速衰老。且TAC(0.5mM)能够诱导WS成纤维细胞中TERT的表达。在该WS模型中,定量PCR和荧光原位杂交(FISH)分析均显示,相对于对照组,长期TAC处理导致内源性端粒长度增加。这表明TAC/ TERT介导的端粒添加能有效地修复短端粒的DNA损伤,并且人原代成纤维细胞保留了增殖能力。
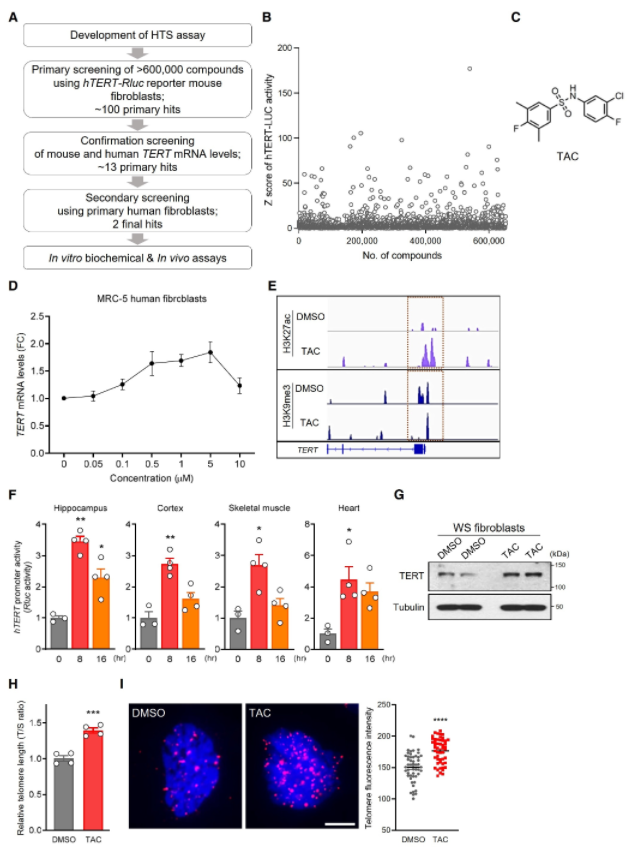
图1. TERT小分子激活剂的鉴定
为了进一步研究下游信号级联和与TAC诱导TERT表达相关的TERT启动子原件,研究者们首先使用磷酸激酶阵列分析了激酶极其底物的磷酸化谱。发现在人原代MRC5细胞中,TAC处理后细胞外信号调节激酶(ERK)及其下游效应物S6激酶的磷酸化持续增加。因此,用MEK激酶抑制剂抑制ERK可消除TAC诱导的MRC5细胞中ERK的磷酸化和TERT上调。
接下来,他们研究了不同体细胞类型的转录组学变化,以阐明将ERK激活与TERT转录控制联系起来的潜在转录因子及其结合元件。通过对人类正常成纤维细胞和诱导多能干细胞(iPSC)衍生神经元的转录组分析,研究者观察到,TAC(0.5mM, 1h)急性处理导致两种人类细胞类型中只有有限数量的常见基因被显著诱导。其中,FOS和SOGA3,在处理后的两种细胞类型中都表现出显著的上调。FOS编码活化蛋白1 (AP-1)转录复合物的主要成分,在两种细胞中被鉴定为受TAC调控最显著的基因。这证明TAC处理能特异性诱导TERT表达及其下游转录效应。作者同时发现位于人类TERT基因上4kb调控区域内有两个AP-1结合位点。随后,作者构建了一个包含来自TERT基因转录起始位点的4kb上游序列的人TERT启动子-荧光素酶报告子,以探究TERT启动子激活是否需要AP-1基序。转染MRC5细胞后,用TAC刺激细胞能够诱导人成纤维细胞的TERT报告活性。且单缺失和双缺失AP-1基序都能显著消除TAC诱导的TERT启动子活性。染色质免疫沉淀和实时定量PCR (ChIP-qPCR)分析显示,TAC处理导致内源性AP-1复合物亚基FOS募集到内源性TERT启动子中的两个AP-1结合基序。总之,这些数据表明,TAC通过MEK/ERK/AP-1途径特异性激活TERT的转录。
图2. TAC激活MEK/ERK/AP-1级联,上调TERT基因转录
接下来,作者评估了TAC介导的TERT诱导是否能减轻端粒完好的老年小鼠的机体衰老。对12月龄小鼠外周血单个核细胞的RNA测序结果显示,TAC处理的中年小鼠外周血中TERT蛋白水平显著升高。经过1周的治疗,发现TAC处理组中和小鼠衰老相关的关键特征显著减少。如衰老关键驱动因子p16Ink4a以及其它和衰老相关的分泌表型(SASP)成分-IL-1α,IL-1β,Mmp-3和Vegf 等都表现出明显的减少。相反,TAC处理能同时诱导生物体中生长和自然杀伤细胞激活。而这些特征在正常小鼠中是随着年龄增长而下降的。在TERT缺失的小鼠中,TAC介导的p16Ink4a抑制被消除。表明TERT对TAC诱导的p16Ink4a沉默是必需的。对Tert+/+、Tert+/- 和Tert-/-小鼠大脑的定量RT-PCR分析证实Tert+/-小鼠的DNMT3b甲基化转移酶的水平明显下调,Tert-/-小鼠的DNMT3b水平进一步下调,表明TERT水平和体内Dnmt3b表达呈正相关。相应地,ChIP测序分析表明,TERT与DNMT3b启动子结合。这些结果表明,TERT不仅在高增殖细胞中,而且在终末分化细胞中也可作为转录调节剂。
鉴于DNMT3b介导的DNA甲基化与p16INK4a转录抑制有关,研究者们随后探究了TAC治疗是否能够诱导体内p16InkK4a启动子的高甲基化。结果显示,与对照组相比,TAC治疗后中年小鼠组织中p16InkK4a启动子区域甲基化的CpG位点显著增加。此外,给予TAC治疗6个月能减少老年小鼠多组织中衰老细胞的负荷,增加促炎症因子的产生。因此,TAC驱动的TERT上调减少了年龄依赖性组织衰老,并调节了细胞衰老的主要遗传驱动因素,包括p16InkK4a和SASP成分。
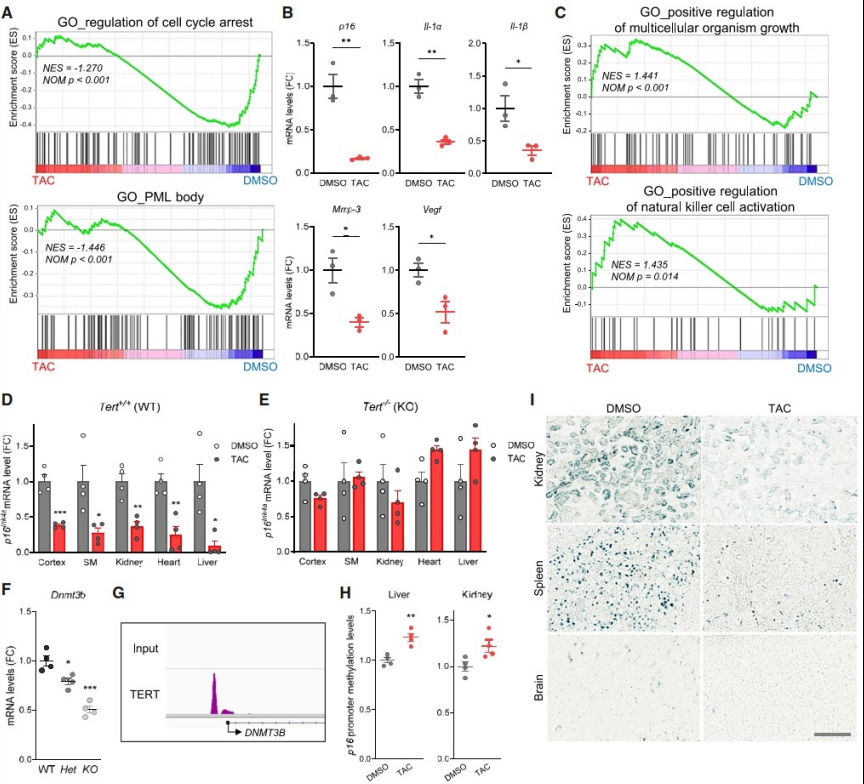
图3. TAC可在体内减弱多种衰老特征
为了进一步了解TAC对基因表达程序的影响,对中年(约12- 14月龄)C57BL/6小鼠的海马组织进行了RNA-seq分析,这些小鼠分别接受了载药或TAC治疗3周。值得注意的是,TAC治疗诱导了与成人海马神经发生和大脑功能正相关基因的表达显著增加。此外,通路富集分析显示,TAC治疗导致中年小鼠海马突触电位、轴突引导、海马/干细胞发育、端粒维持、神经母细胞增殖、多巴胺能神经发生/中枢神经系统神经元分化和丝裂原活化蛋白激酶(MAPK)家族信号级联相关通路的激活。相反,和衰老相关的细胞因子和炎症因子在TAC处理下都显著下调。免疫组织化学和免疫荧光分析显示,TAC治疗4周显著增加了海马齿状回(DG)中表达DXC的新生神经元的数量。这表明TAC确实可以增强老年大脑的再生能力。因此,TERT的药理激活诱导了与返老还童相关的基因特征,并刺激了成年小鼠海马体中的成年神经发生。
慢性神经炎症是大脑衰老的普遍特征,胶质细胞是大脑神经炎症的主要参与者,小胶质细胞的激活被认为是大多数大脑衰老和神经退行性疾病中可见的神经炎症的标志。与对照组相比,TAC给药显著降低了衰老小鼠大脑中IBA1阳性激活的小胶质细胞水平。在TAC处理的海马组织中,包括IL-1β、IL-6和TNF-α在内的促炎细胞因子的含量也相对于对照组有所减少。经过6个月的治疗,接受TAC治疗的老年小鼠在三个海马依赖性认知测试-巴恩斯迷宫和新位置识别任务中的表现都有明显改善。总之,这些发现表明,适度的tac诱导内源性TERT水平的增加不仅改善了老年小鼠海马依赖的认知功能,还增强了神经肌肉功能,而没有任何明显的不良后果。
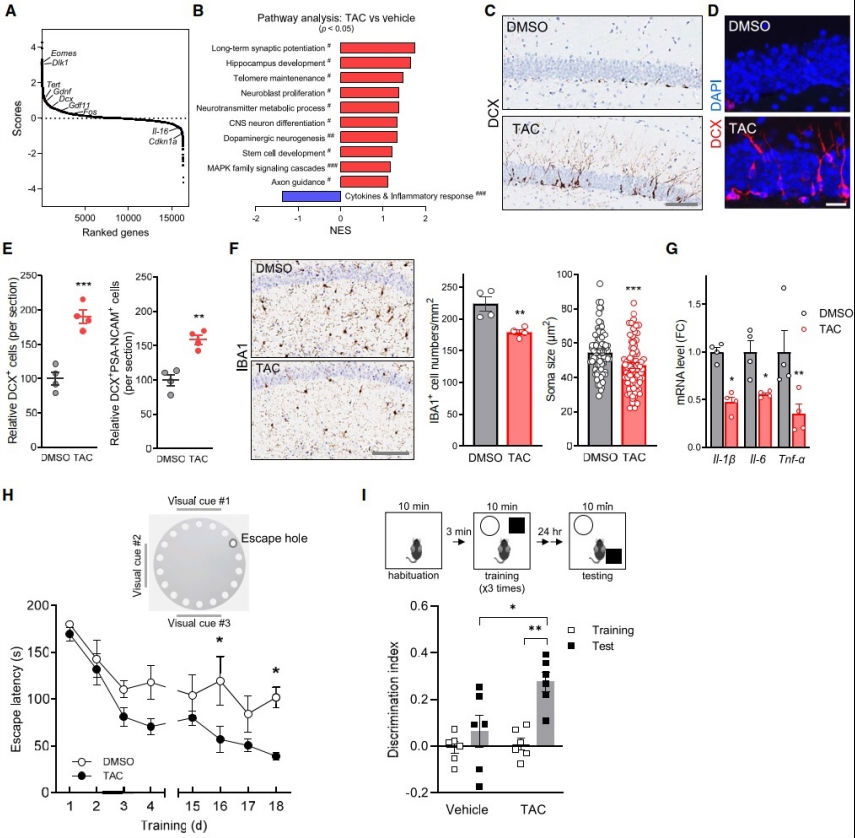
图4. 长期TAC给药可改善大脑衰老
本研究强调了衰老器官系统的显著再生能力,以及在自然衰老过程中药理学调节衰老特征的能力。研究报告发现了一种新的小分子端粒酶激活剂TAC,该激活剂可诱导TERT在人和小鼠体细胞组织中的生理表达。TAC能有效地抵消成人体细胞中TERT基因的表观遗传沉默,从而影响控制衰老标志的基因的表达。值得注意的是,TAC处理显著减少了不同组织中衰老细胞的比例。同时,DNMT3B介导的主细胞死亡基因p16Ink4a的抑制以TERT依赖的方式进行。此外,在老年小鼠中长期给予脑渗透TAC可减少神经炎症和炎症细胞因子,增强与年轻化相关的基因特征,促进成年神经发生,并在没有明显副作用的情况下保持认知功能。因此,生理TERT激活有望缓解小鼠自然衰老过程中的衰老表型。
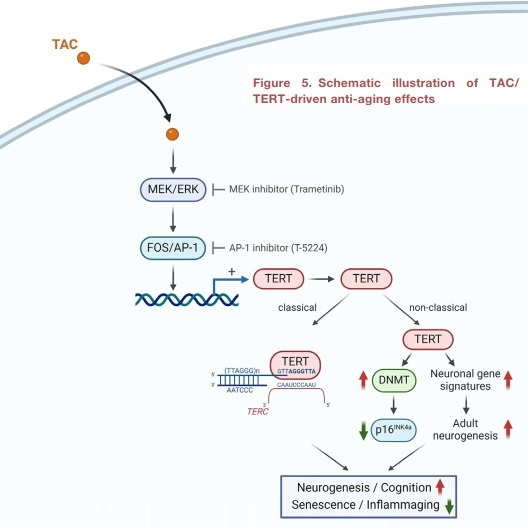
图5. TAC/TERT驱动的抗衰老效果示意图
云克隆开发了外泌体研究中涉及到的相关靶标的蛋白、抗体以及试剂盒产品。靶标及核心货号如下,供参考: