细胞凋亡在神经退行性疾病中的关键角色与治疗新希望
神经退行性疾病(ND)是一组异质性复杂疾病,其特征是神经元丢失和神经系统不同区域的进行性退行性变性。ND是世界范围内一个重大的健康问题,发病率不断上升。尽管ND的确切发病机制尚不清楚,但已经提出了遗传、表观遗传和环境因素之间的复杂相互作用。迄今为止,还没有开发出有效的治疗方法来减缓、阻止或预防任何ND。动物模型和细胞系研究表明,细胞凋亡似乎在阿尔茨海默病、帕金森病、亨廷顿氏病和肌萎缩侧索硬化症等几种ND的进展中起着关键作用。此外,在ND患者的大脑中发现了许多垂死的神经元,这些情况通常与严重的细胞损失有关,伴随着典型的凋亡形态特征,如染色质凝缩、DNA断裂和半胱氨酸蛋白酶的激活。因此,靶向细胞凋亡可能延缓ND进展。
1. 阿尔茨海默病的多靶点联合治疗
阿尔茨海默病(AD)的复杂病理严重限制了单靶点药物干预的有效性,因此需要多管齐下的治疗策略。南开大学化学学院功能高分子材料重点实验室Dong-Sheng Guo团队以β-淀粉样蛋白(Aβ)纤维性颤动和氧化应激为模型,构建了胍修饰杯芳烃与抗坏血酸棕榈酸酯共组装并在杯芳烃腔内负载植酸二钾的超分子多功能整合体(IP6@GCA/AP)[1]。这个多用途系统可以同时解决一系列关键事件,包括抑制Aβ的产生和聚集、Aβ原纤维的分解、Aβ代谢清除的加速以及氧化应激的调节(图1),这被证实可以显著改善5×FAD小鼠的认知障碍,减少Aβ斑块含量,神经炎症和神经元凋亡。这为解决靶点选择中的困惑提供了一条途径,并实现了最佳的功能整合,以寻求易于获得的个性化AD处方。

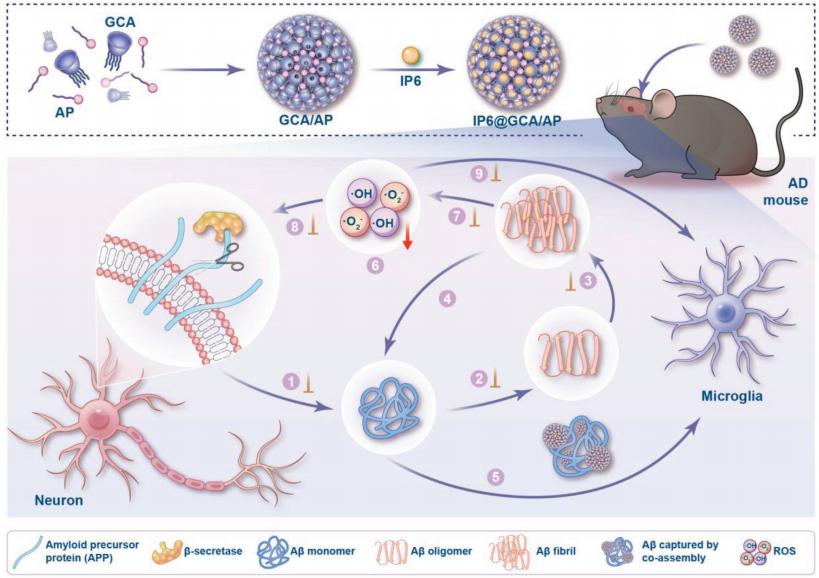
图1 IP6@GCA/AP共组装及其在Aβ纤维性颤动和氧化应激病理过程中的综合干预
2. Mtf1是突变亨廷顿蛋白毒性的抑制剂
亨廷顿氏病(HD)是一种由亨廷顿蛋白(HTT)基因CAG重复扩增引起的神经退行性疾病。由此产生的突变HTT(mHTT)蛋白通过多种机制诱导毒性和细胞死亡,目前尚无有效的治疗方法。意大利帕多瓦大学生物学系Graziano Martello团队在多能性小鼠胚胎干细胞(ESCs)中进行全基因组筛查,以鉴定mHTT毒性的抑制因子[2]。在已鉴定的与HD相关过程相关的抑制因子中,他们重点研究了金属反应元件结合转录因子1(Mtf1)。Mtf1的强制表达抵消了mHTT在小鼠ESCs和人类神经元前体细胞中引起的细胞死亡和氧化应激。在斑马鱼中,Mtf1减少了mHTT诱导的畸形和凋亡。在R6/2小鼠中,Mtf1消除了运动缺陷,减少了mHTT聚集和氧化应激(图2)。这些结果表明,Mtf1表达抑制了mHTT在体外和两种体内HD模型中引起的有害影响,表明靶向Mtf1可能是一种针对HD的治疗策略。


图2 AAV载体递送Mtf1缓解R6/2小鼠的运动缺陷
3. α-突触核蛋白基因进行表观遗传修饰治疗帕金森病
在帕金森病(PD)患者中,SNCA(α-synuclein基因)的异常甲基化已被报道,可能是一个潜在的治疗靶点。陕西师范大学生命科学学院药物资源与天然药物化学重点实验室Xiaobing Wang团队建立了一个基于外泌体CRISPR干预系统的表观遗传调控平台[3]。在聚焦超声(FUS)的帮助下,打开血脑屏障,携带RVG靶向肽、sgRNA和dCas9-DNMT3A的工程外泌体(命名为RVG CRISPRi Exo)被有效地递送到脑损伤中,并诱导SNCA的特异性甲基化(图3)。在体内,FUS联合RVG CRISPRi Exo显著改善了PD小鼠的运动表现、平衡协调和神经敏感性,大大下调了建模引起的α-synuclein(α-syn)的升高,挽救了细胞凋亡,缓解了小鼠PD的进展。焦磷酸测序结果表明,RVG CRISPRi Exo可以在SNCA的特定位点甲基化CpG,这种微调编辑在PD模型小鼠中取得了良好的治疗效果。在体外,RVG CRISPRi Exo下调SNCA转录本和α-syn表达,减轻神经元细胞损伤。总的来说,这些发现为基于工程外泌体的靶向脑纳米递送的发展提供了原理证明,并为脑疾病的表观遗传调控提供了见解。

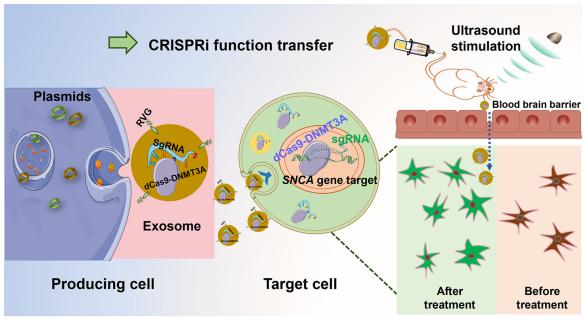
图3 RVG CRISPRi Exo在FUS引导下实现对PD模型小鼠SNCA表达的靶向干预
云克隆不仅可提供多种神经系统疾病动物模型,包括帕金森、阿尔兹海默症、焦虑症、慢性应激抑郁等,涵盖常见神经系统疾病。还具有各类神经系统疾病和细胞凋亡检测指标及上述Aβ、a-Syn、Mtf1等相关产品,可助力广大科研工作者进行细胞凋亡与神经系统疾病相关研究。

参考文献
[1]Li WB, Xu LL, Wang SL, et al. Co-Assembled Nanoparticles toward Multi-Target Combinational Therapy of Alzheimer's Disease by Making Full Use of Molecular Recognition and Self-Assembly. Adv Mater. 2024;36(28):e2401918.(IF=27.4)
[2]Ferlazzo GM, Gambetta AM, Amato S, et al. Genome-wide screening in pluripotent cells identifies Mtf1 as a suppressor of mutant huntingtin toxicity. Nat Commun. 2023;14(1):3962.(IF=14.7)
[3]Kong W, Li X, Guo X, et al. Ultrasound-Assisted CRISPRi-Exosome for Epigenetic Modification of α-Synuclein Gene in a Mouse Model of Parkinson's Disease. ACS Nano. 2024;18(11):7837-7851.(IF=15.8)