揭秘心脏病的隐形杀手:细胞凋亡的作用与治疗新希望
尽管细胞凋亡可以作为致病介质的概念在心血管医学中比在其他医学领域来得晚一些,但在过去的几十年里,对细胞凋亡在心脏病中的作用的研究取得了爆炸性的进展。在各种心血管疾病中,心肌梗死尤其值得注意,因为其死亡率和发病率都很高。在心肌梗死的所有阶段,心脏中都检测到了细胞凋亡,这表明细胞凋亡可能是急性缺血阶段大量心肌细胞死亡的原因,也是亚急性和慢性阶段存活细胞逐渐丧失的原因。现在广泛的研究表明,细胞凋亡在几乎所有类型的心脏病的病理中都有重要作用,不仅是与缺血相关的疾病(缺血再灌注、心肌梗死的急性和慢性阶段、缺血性心肌病和冬眠心肌),还有其他心脏病,如扩张型心肌病。因此,评估凋亡在心血管疾病中的作用,可能有助于开发新的治疗方法抑制炎症和慢性心血管疾病的进展。
1. 细胞凋亡与动脉粥样硬化
斑块内出血被(IPH)认为是斑块进展的主要原因,部分原因是刺激CD163+巨噬细胞的流入。美国马里兰大学医学院Aloke V. Finn团队发现CD163+巨噬细胞通过诱导纤维帽内的促凋亡内皮细胞向间充质转化(EndMT)引起斑块进展[1]。在斑块内出血病变、破裂切片与粥样硬化切片中,纤维帽更薄,CD163+巨噬细胞积聚更大,纤维帽中CD31/FSP-1双阳性细胞和TUNEL阳性细胞数量更多。CD163+巨噬细胞释放的促炎细胞因子激活NF-κB(核因子κ β)信号传导,直接调节Snail的表达,这是EndMT诱导过程中的一个关键转录因子。Western blot分析cleaved caspase-3和芯片分析显示,CD163+巨噬细胞诱导的内皮细胞凋亡被激活(图1)。此外,在动脉粥样硬化易发小鼠中,CD163缺失表明CD163是EndMT和斑块进展所必需的。这些结果表明IPH刺激的CD163+巨噬细胞通过在纤维帽内诱导EndMT来促进斑块进展,进而导致这些细胞凋亡和纤维帽变薄。
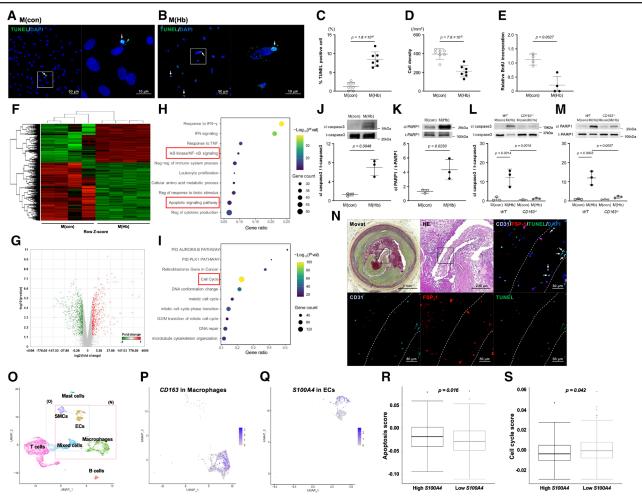
图1 CD163巨噬细胞诱导的EndMT表现出促凋亡表型
2. 细胞凋亡与心肌缺血/再灌注损伤
ASPP1作为p53的辅助因子在调节细胞凋亡方面至关重要,以促进其在细胞核中的转录活性。然而,细胞质ASPP1是否影响p53核运输及其在心脏病中的作用仍然未知。哈尔滨医科大学第一附属医院NHC细胞移植重点实验室Zhenwei Pan团队探讨了ASPP1和p53核易位的分子机制及其对心肌缺血/再灌注(I/R)损伤的影响[2]。在正常情况下,ASPP1和p53共定位在新生小鼠心室心肌细胞的细胞质中,而在缺氧/复氧处理后,它们都上调并转移到细胞核中。ASPP1和p53的核转位是相互依存的,因为ASPP1或p53的敲除会减弱另一个的核转位。抑制importin-β1导致缺氧/复氧刺激下新生小鼠心室肌细胞中p53和ASPP1的细胞质隔离。ASPP1的敲除抑制了Bax、PUMA和Noxa的表达(图2),这些是p53的直接凋亡相关靶点。心肌细胞特异性ASPP1转基因过表达加重了I/R损伤,表现为梗死面积增加和心功能受损。相反,ASPP1的敲除减轻了心脏I/R损伤。此外,抑制p53显著减弱了ASPP1在体外和体内的促凋亡活性和有害作用。研究结果表明,干扰ASPP1的表达或ASPP1和p53之间的相互作用以阻断其核运输是心脏I/R损伤的重要治疗策略。
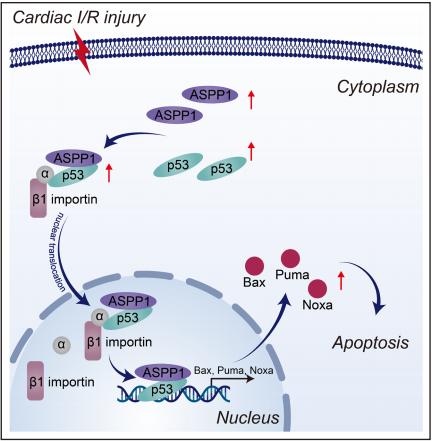
图2 ASPP1对心脏I/R损伤的调控示意图
3. 细胞凋亡与心肌梗死
尽管医学取得了进步,但心肌梗死的长期治疗仍然具有挑战性。组织工程显示出修复心肌梗死的希望,但植入的复杂性和不确定的结果构成了障碍。microRNAs调节参与细胞凋亡、血管生成和心肌收缩的基因,使其在长期修复中具有重要价值。南方医科大学基础医学院Xiaozhong Qiu团队发现心肌梗死中miR-199a-5p的表达下调[3]。将miR-199a-5p心肌内注射到雄性大鼠的梗死区,揭示了其对心脏的双重保护作用。miR-199a-5p靶向AGTR1,减少心肌梗死后的早期氧化损伤,以及MARK4,MARK4影响长期心肌收缩性并增强心脏功能(图3)。为了高效且特异性地将miR-199a-5p递送至缺血心肌组织,他们使用CSTSMLKAC肽构建P-MSN/miR199a-5p-纳米颗粒。静脉注射这些纳米颗粒可以减少心肌损伤并保护心脏功能。这项研究结果表明,P-MSN/miR199a-5p纳米颗粒通过增强收缩和抗凋亡来修复心肌梗死的有效性。
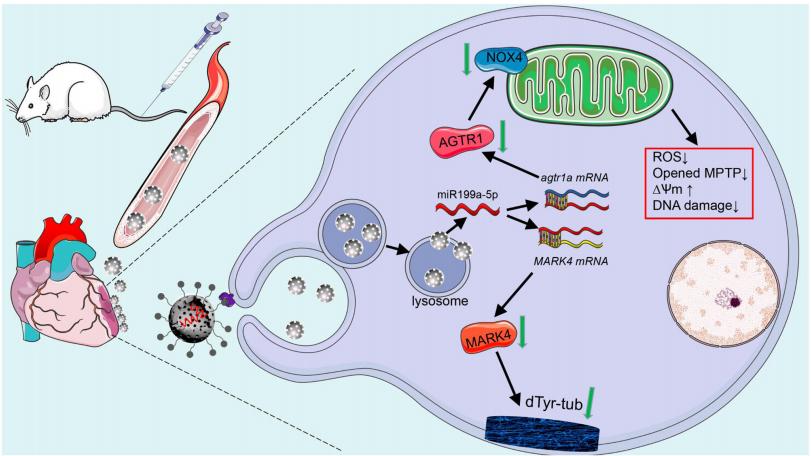
图3 miR199a-5p用于心肌梗死的长期修复
云克隆不仅可提供多种心血管系统疾病模型,包括动脉粥样硬化、心肌肥厚、心肌梗死、心律失常、心力衰竭等,涵盖常见心血管系统疾病。还具有多个物种心脏微血管内皮细胞、心肌细胞、心肌成纤维细胞、心包膜成纤维细胞等原代细胞产品和各类心血管系统与凋亡信号通路常用指标及上述CD31、NF-κB、PUMA、Bax、AGTR1等相关产品,可助力广大科研工作者进行心血管系统疾病研究。
云克隆心血管系统疾病模型


云克隆心血管相关指标

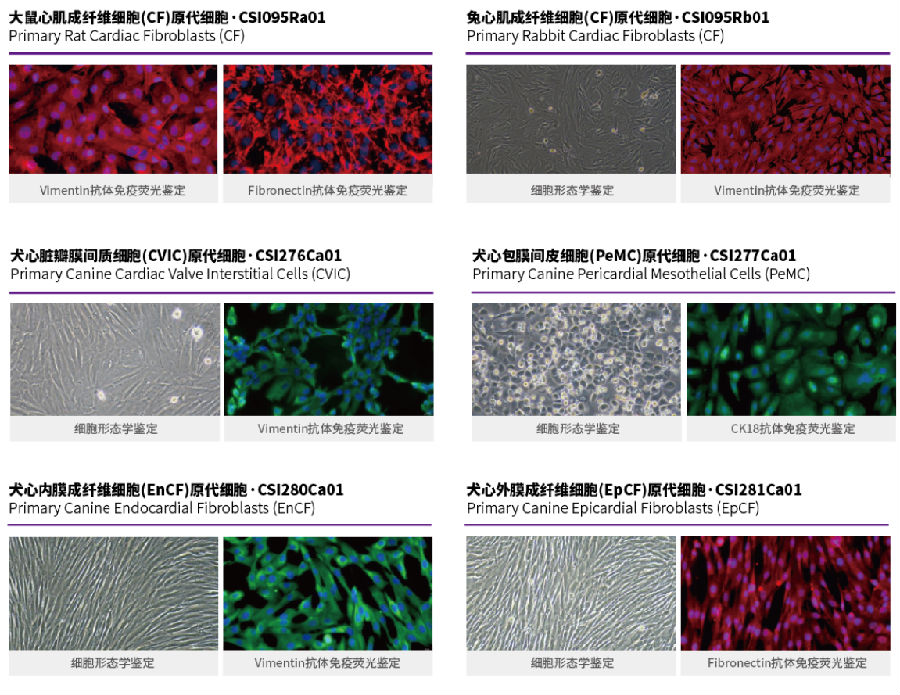
云克隆心血管相关原代细胞

参考文献
[1]Mori M, Sakamoto A, Kawakami R, et al. CD163+ Macrophages Induce Endothelial-to-Mesenchymal Transition in Atheroma. Circ Res. 2024;135(2):e4-e23. (IF=16.5)
[2]Yang Y, Zhang Y, Yang J, et al. Interdependent Nuclear Co-Trafficking of ASPP1 and p53 Aggravates Cardiac Ischemia/Reperfusion Injury. Circ Res. 2023;132(2):208-222. (IF=16.5)
[3]Chen Y, Liu S, Liang Y, et al. Single dose of intravenous miR199a-5p delivery targeting ischemic heart for long-term repair of myocardial infarction. Nat Commun. 2024;15(1):5565. (IF=14.7)