揭秘细胞死亡新视角:坏死性凋亡的调控机制与潜在医疗应用
以前,人们认为凋亡和坏死是两种不同的细胞死亡形式,前者受到调节,后者是偶然的。新的数据已经反驳了这种观点,实验证据支持分子调控并非细胞凋亡所独有,某些形式的坏死还涉及由膜受体和细胞内信号转导分子组成的调节机制。研究最充分的调节性或程序性坏死形式称为坏死性凋亡。坏死性凋亡是一种受调节的细胞死亡形式,严重依赖于受体相互作用丝氨酸苏氨酸激酶3(RIPK3)和混合谱系激酶结构域样(MLKL),通常表现为坏死的形态特征。已经表明坏死性凋亡在各种病理生理条件下会导致细胞死亡,包括病毒感染、急性肾损伤和心脏缺血/再灌注。此外,坏死性凋亡在肿瘤发生和转移中也具有重要作用。近期,多篇文献报道了坏死性凋亡相关研究,可能为开发新的坏死性凋亡相关药物和疗法提供帮助。
1. PARP5A和RNF146相分离可抑制RIPK1依赖性坏死性凋亡
相分离是介导生物分子凝聚物形成及其功能的重要机制。坏死性凋亡是由TNFR1下游的RIPK1、RIPK3和MLKL介导的程序性细胞死亡的裂解形式,与许多人类疾病有关。然而,目前尚不清楚坏死性凋亡是否受相分离的调节。中国科学院上海有机化学研究所生物与化学跨学科研究中心Daichao Xu团队的研究表明在衔接蛋白TAX1BP1诱导坏死性凋亡和募集后,PARP5A及其结合伴侣RNF146通过多价相互作用形成液体状凝聚体,对活化的RIPK1进行聚ADP核糖基化(PARylation)和PARylation依赖性泛素化(PARdU)[1]。他们发现PARdU主要发生在RIPK1的K376残基上,它促进激酶激活的RIPK1蛋白酶体降解以抑制坏死性凋亡(图1)。这些数据表明,RIPK1 K376上的PARdU提供了一种替代的细胞死亡检查点,该检查点由PARP5A和RNF146对坏死性凋亡的相分离依赖性控制介导。
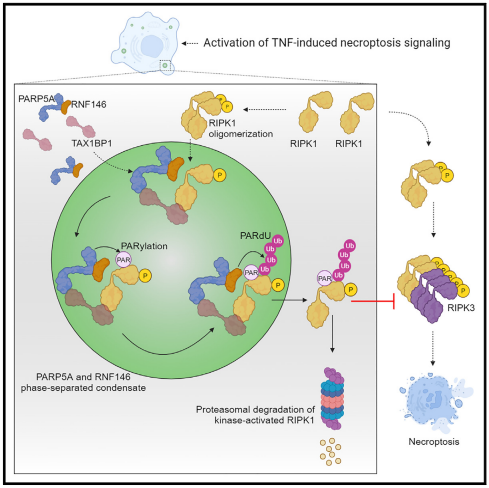
图1 RIPK1的K376残基PARdU,促进激酶激活的RIPK1蛋白酶体降解,以控制坏死性凋亡
2. HSPA8通过抑制和逆转功能性淀粉样蛋白的形成来抑制坏死性凋亡
含RHIM基序的淀粉样蛋白是迄今为止发现的最大的功能性淀粉样蛋白家族,在介导哺乳动物细胞坏死性凋亡信号转导中起着重要作用。上海中国科学院细胞生物学国家重点实验室Liming Sun团队将热休克蛋白家族A成员8(HSPA8)鉴定为一种新型酶,它直接分解RHIM-淀粉样蛋白以抑制细胞和小鼠中的坏死性凋亡信号传导[2]。HSPA8通过疏水性六肽基序N(X1)φ(X3)特异性识别含有RHIM的蛋白质。HSPA8的SBD结构域与含RHIM的蛋白质相互作用,阻止邻近的RHIM单体堆积成功能性纤维;此外,由于NBD结构域通过ATP水解提供能量,HSPA8将预先形成的RHIM淀粉样蛋白分解成非功能性单体(图2)。利用这种淀粉酶活性,HSPA8逆转了引发剂RHIM淀粉样蛋白(由RIP1、ZBP1和TRIF形成),以防止坏死性凋亡的发生,并逆转了RIP3淀粉样蛋白,以防止坏死性凋亡的执行,从而消除了多水平的RHIM淀粉状蛋白,有效地防止了自发性坏死性凋亡激活。
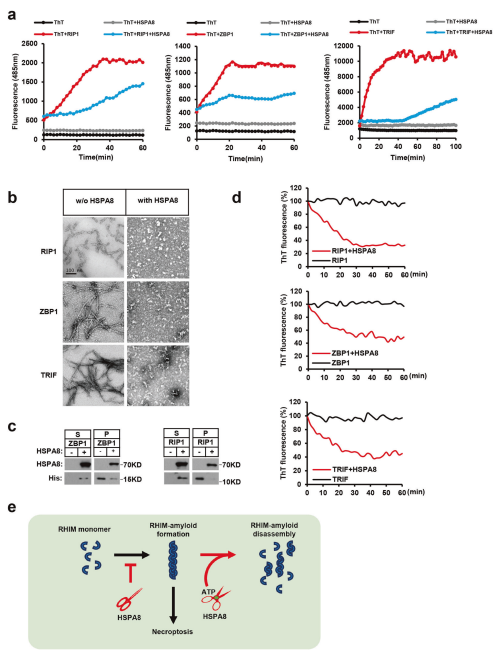
图2 HSPA8抑制引发剂RHIM原纤维的形成
3. MLKL聚合诱导的溶酶体膜通透性促进坏死性凋亡
MLKL形成淀粉样聚合物以促进坏死性凋亡。然而,这些聚合物触发细胞死亡的机制尚不清楚。美国南佛罗里达大学莫尔萨尼医学院Zhigao Wang团队确定在诱导坏死性凋亡的过程中,活化的MLKL会转移到溶酶体膜上[3]。MLKL的后续聚合诱导溶酶体聚集和融合,最终导致溶酶体膜通透性(LMP)。这种LMP导致溶酶体内容物快速释放到细胞质中,导致组织蛋白酶水平大幅上升,组织蛋白酶B(CTSB)是随后细胞死亡的重要因素,因为它切割了许多对细胞存活至关重要的蛋白质。重要的是,化学抑制或敲除CTSB可以保护细胞免受坏死性凋亡(图3)。此外,MLKL N-末端结构域(NTD)的诱导聚合也会触发LMP,导致CTSB释放和随后的细胞死亡。这些发现清楚地确立了MLKL聚合诱导的溶酶体膜通透性(MPI-LMP)在坏死性凋亡过程中的关键作用。

图3 CTSB的缺失可防止蛋白质切割并抑制NTD-DmrB细胞的坏死性凋亡
云克隆不仅可提供多种细胞死亡(凋亡、自噬、铁死亡、焦亡)信号通路相关产品,包括TNFα、CASP3、CTSK、NFkB、CASP9、Bcl2、BECN1、CTSD、CTSL、ERK1、ERK2等,还具有上述RIPK3、MLKL、PARP5A、TNFR1、HSPA8、CTSB等相关蛋白检测产品,可助力广大科研工作者进行细胞死亡相关研究。
参考文献
[1]Hou S, Zhang J, Jiang X, et al. PARP5A and RNF146 phase separation restrains RIPK1-dependent necroptosis. Mol Cell. 2024;84(5):938-954.e8. (IF=14.5)
[2]Wu E, He W, Wu C, et al. HSPA8 acts as an amyloidase to suppress necroptosis by inhibiting and reversing functional amyloid formation. Cell Res. 2023;33(11):851-866. (IF=28.1)
[3]Liu S, Perez P, Sun X, et al. MLKL polymerization-induced lysosomal membrane permeabilization promotes necroptosis. Cell Death Differ. 2024;31(1):40-52. (IF=13.7)