坏死性凋亡:心血管疾病治疗的新靶点与希望
心血管疾病在世界范围内都有着较高的发病率,是导致死亡的主要原因,因此对人类健康构成严重威胁。许多因素,包括遗传和环境因素、代谢紊乱、炎症、氧化应激、线粒体功能障碍和细胞死亡,都参与心血管疾病的发病机制,而细胞死亡引起的心肌细胞丢失在心血管疾病中起着至关重要的作用。作为一种调节性坏死形式,坏死性凋亡由死亡受体介导,并通过激活受体相互作用蛋白激酶3(RIPK3)及其下游底物混合谱系激酶样结构域(MLKL)来执行。研究表明坏死性凋亡在心肌稳态、缺血性损伤、病理重塑和心力衰竭中起重要作用。因此,靶向坏死性凋亡信号通路可能在治疗心血管疾病中提供治疗益处。
1. 坏死性凋亡与糖尿病心肌病
细胞死亡是导致糖尿病性心力衰竭的核心事件。然而,在糖尿病心脏中,细胞死亡途径的时间序列和干预特定细胞死亡类型的确切时间在很大程度上仍然未知。复旦大学生物医学研究所Yunzeng Zou团队发现坏死性凋亡在糖尿病晚期细胞凋亡后被激活,是导致心功能不全的原因[1]。大麻素受体2(CB2R)是坏死性凋亡的关键调节因子。在正常葡萄糖水平下,CB2R在丝氨酸520位点抑制S6激酶介导的BACH2磷酸化,从而导致BACH2易位到细胞核,其中BACH2转录抑制坏死性凋亡基因Rip1、Rip3和Mlkl。在高血糖条件下,高葡萄糖以β-arrestin 2依赖性方式诱导CB2R内化;此后,MLKL在丝氨酸352位点磷酸化CB2R,并通过泛素修饰促进CB2R降解(图1)。CB2R的心脏再表达挽救了糖尿病诱导的心肌细胞坏死性凋亡和心脏功能障碍,而Bach2的心脏敲除减少了CB2R介导的有益作用。CB2R通过与BACH2相互作用转录抑制坏死性凋亡;反过来,MLKL形成负反馈以磷酸化CB2R。这项研究提供了控制糖尿病心功能障碍的一种有前途的替代策略。
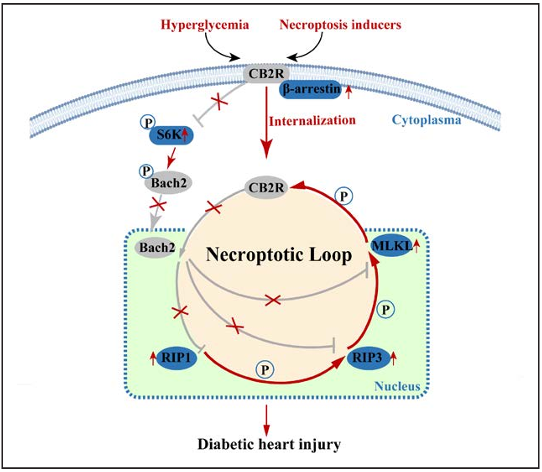
图1 CB2R为中心的分子反馈回路驱动糖尿病性心脏病的坏死性凋亡
2. 坏死性凋亡与缺血/再灌注(I/R)损伤
与PIWI蛋白相互作用的RNA(piRNA)在各种心血管疾病中高度表达。然而,它们在I/R损伤引起的心肌细胞死亡中的作用,仍然难以捉摸。青岛大学医学院Kun Wang团队发现了一种心脏坏死性凋亡相关piRNA(HNEAP),它通过靶向DNA甲基转移酶1(DNMT1)介导的激活转录因子7(Atf7)mRNA转录物的5-甲基胞嘧啶(m5C)甲基化来调节心肌细胞坏死性凋亡[2]。在缺氧/复氧(H/R)暴露的心肌细胞和I/R损伤的小鼠心脏中,HNEAP表达水平显着升高。HNEAP缺失抑制了小鼠心肌细胞坏死性凋亡并改善了心脏功能。从机制上讲,HNEAP直接与DNMT1相互作用,并减弱Atf7 mRNA转录物的m5C甲基化,从而增加Atf7的表达水平。ATF7可进一步下调坏死性凋亡抑制剂Chmp2a的转录,导致Chmp2a水平降低和心肌细胞坏死性凋亡的进展(图2)。因此,HNEAP-DNMT1-ATF7-CHMP2A轴可能是减轻缺血性心脏病坏死性凋亡引起的心脏损伤的潜在靶点。

图2 Atf7在心肌细胞坏死性凋亡期间调节CHMP2A的表达
3. 坏死性凋亡与血栓形成
血小板是在止血和病理性血栓形成中起核心作用的循环细胞。印度巴纳拉斯印度教大学医学科学研究所Debabrata Dash团队证明了MLKL在激动剂刺激的血小板转化为活性止血单位最终进展为坏死性凋亡的开创性贡献[3]。凝血酶等生理激动剂以PI3K/AKT依赖的方式诱导血小板中MLKL的磷酸化和随后的寡聚化。抑制MLKL显著抑制了激动剂诱导的血小板止血反应,包括血小板聚集、整合素激活、颗粒分泌、促凝剂表面生成、细胞内钙升高、细胞外囊泡脱落、血小板-白细胞相互作用和动脉剪切下的血栓形成(图3)。长期暴露于凝血酶会引发MLKL寡聚化和移位到质膜,形成局灶性簇,导致膜通透性逐渐增加和血小板存活率下降,而PI3K/MLKL抑制剂可以阻止这种情况。总之,MLKL在受刺激血小板从相对静止的细胞转变为功能/代谢活跃的血栓前状态及其随后进展为坏死性凋亡中起着至关重要的作用。
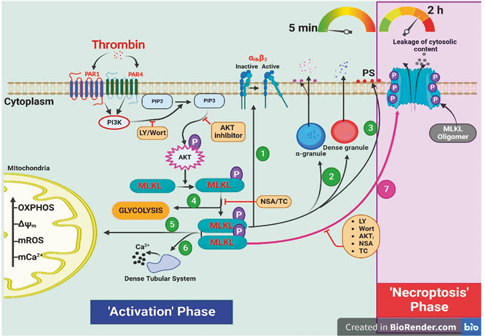
图3 MLKL在激动剂诱导的血小板活化和坏死性凋亡中发挥作用
云克隆不仅可提供多种心血管系统疾病模型,包括动脉粥样硬化、心肌肥厚、心肌梗死、心律失常、心力衰竭等,涵盖常见心血管系统疾病。还具有多个物种心脏微血管内皮细胞、心肌细胞、心肌成纤维细胞、心包膜成纤维细胞等原代细胞产品和各类心血管系统与凋亡信号通路常用指标及上述CB2R、β-arrestin 2、DNMT1、Atf7、PI3K等相关产品,可助力广大科研工作者进行心血管系统疾病研究。
相关动物模型
心肌肥厚(CH)小鼠模型• DSI548Mu03
建模方法
1. 小鼠选择:SPF 级生产的小鼠,选择 6-8 周龄健康雄性小鼠为实验对象。
2. 称重麻醉备皮:准确称取小鼠体重(g),行腹腔注射麻醉小鼠,待小鼠充分麻醉倒(约 3-5min)后,用小鼠剃毛器剃除小鼠颈部及胸前毛发(充分暴露手术区)。
3. 倒置小鼠使小鼠头部在手术人员一侧 抬升头部在 30°,颈部中间竖直开口至胸上肋骨起始处,沿肋骨起始处肋中线向下剪开 0.5mm 扩大视野,从颈部气管钝性分离至看见胸腺。轻轻拨开胸腺游离脂肪便可清晰观察到主动脉弓,从主动脉弓底引 7-0 不可吸收缝合线,连同自制缩窄工具(27G)勒紧打死结,抽出缩窄工具。完成 TAC 手术,整个实验过程保持小鼠体温 37℃左右。
4. 缝合:结扎完成后,6-0 缝线完全缝合胸腔前端开口(保证无缝隙、无错位),最后用 5-0 缝线将皮肤切口缝合完整。
5. 术后管理:术后密切关注小鼠状态。待小鼠自然苏醒后,放入干净的饲养笼,填写手术记录卡片,放回饲养室,密切关注小鼠术后状态以及死亡情况并做好相应记录。

心肌梗死(MI)大鼠模型• DSI504Ra02
建模方法:
1. 麻醉大鼠,用小动物剃毛器剃除大鼠胸部及腋下毛发(充分暴露手术区),用碘酒和 75%乙醇术区消毒。
2. 气管插管:麻醉后,夹趾检测无反应即可进行 MI 手术。打开外置光源、显微镜开关,打开呼吸机,设置好各参数(呼吸比 2:1,潮气量 6-8 mL,频率 70 次 /min),将气管插管沿声门插入气管,取下大鼠接上呼吸机,观察大鼠呼吸状况,胸廓起伏与呼吸机频率一致表示插管成功,即可进行 MI 手术。
3. 大鼠采用右侧卧位,用眼科剪在左前肢腋下,用显微剪于三、四肋间打开胸腔充分暴露心脏,显微直镊轻轻夹起少量心包并于左心耳下撕开少许心包,充分暴露左冠状动脉前降支(LAD)或所在区域。
4. 结扎冠状动脉:于显微镜下找到 LAD 走向或可能所在位置 , 持针器持取 5-0 带针缝合线,于左心耳根部下方肺动脉圆锥旁以 5-0 无创缝合线穿过左冠状动脉前降支 ( LAD),以完全阻断 LAD 血流。
5. 关胸:结扎完成后,5-0 缝线完全缝合胸腔开口(保证无缝隙、无错位)关闭胸腔,由内向外逐层缝合各层肌肉和皮肤。
6. 术后管理:术后密切关注大鼠状态,有无呼吸异常等。待大鼠自然苏醒后将大鼠从呼吸机上取下并取下气管插管,正常饲养。
参考文献
[1]Gao P, Cao M, Jiang X, et al. Cannabinoid Receptor 2-Centric Molecular Feedback Loop Drives Necroptosis in Diabetic Heart Injuries. Circulation. 2023;147(2):158-174. (IF=35.5)
[2]Wang K, Li FH, Zhou LY, et al. HNEAP Regulates Necroptosis of Cardiomyocytes by Suppressing the m5 C Methylation of Atf7 mRNA. Adv Sci (Weinh). 2023;10(34):e2304329. (IF=14.3)
[3]Ekhlak M, Kulkarni PP, Singh V, et al. Necroptosis executioner MLKL plays pivotal roles in agonist-induced platelet prothrombotic responses and lytic cell death in a temporal order. Cell Death Differ. 2023;30(8):1886-1899. (IF=13.7)