揭秘神经疾病的细胞死亡之谜:坏死性凋亡与中枢神经系统疾病的关联
坏死性凋亡是一种细胞死亡机制,其形态学特征与坏死相似,但由根本不同的分子途径介导。坏死性凋亡由受体相互作用蛋白激酶1(RIPK1)、RIPK3和假激酶MLKL介导,在阿尔茨海默病(AD)、肌萎缩侧索硬化症(ALS)、多发性硬化症(MS)和帕金森(PD)中促进坏死细胞死亡和神经炎症。不仅如此,坏死性凋亡在中枢神经系统中的角色也扩展到了其他疾病,如中风和脑外伤。这些情况下,细胞外刺激如死亡受体-配体结合或细胞内信号如外来微生物核酸的激活,均可引发坏死性凋亡,导致神经元损伤和功能障碍。已发现坏死性凋亡的基因缺失或药物抑制在多种神经系统疾病中发挥神经保护作用,进一步探索坏死性凋亡在中枢神经系统疾病中的作用可能有利于开发新的有效药物。
1. 坏死性凋亡与脑炎
皮质神经元中TLR3依赖性I型IFN免疫的先天性缺陷是前脑单纯疱疹病毒1(HSV-1)脑炎(HSE)的基础,这是由于不受控制的病毒生长和随后的细胞死亡造成的。美国洛克菲勒大学Shen-Ying Zhang团队报告了一名其他方面健康的HSE患者,该患者是无义(R422*)和移码(P493fs9*)RIPK3变体的复合杂合子[1]。在体外,R422*和P493fs9* RIPK3蛋白在TLR3、TLR4或TNFR1刺激下损害细胞凋亡和坏死性凋亡,以及HSV-1感染后ZBP1/DAI介导的坏死性细胞凋亡。在TNFR1或TLR3刺激后,患者的细胞没有发生细胞凋亡或坏死性凋亡。HSV-1感染后,尽管抗病毒IFN-β和干扰素刺激基因(ISG)的正常诱导,但细胞仍支持病毒的过度生长。然而,这种表型通过应用外源性I型IFN得到了挽救。患者的人类多能干细胞(hPSC)衍生的皮质神经元在HSV-1感染后表现出受损的细胞死亡和增强的病毒生长,RIPK3敲除的hPSC衍生的皮质神经元也是如此(图1)。因此,遗传性RIPK3缺乏症通过损害皮质神经元中HSV-1的细胞死亡依赖性控制,但不损害其产生或对I型IFN的反应,从而赋予HSE易感性。
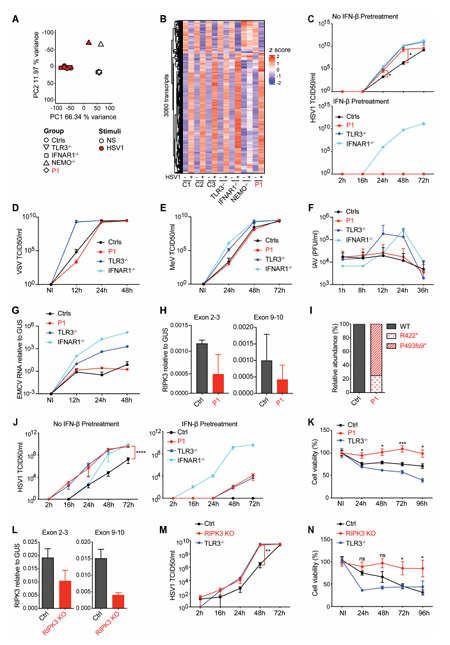
图1 RIPK3缺陷的成纤维细胞和hPSC衍生的皮质神经元对HSV-1的敏感性增强
2. 坏死性凋亡与阿尔兹海默症
神经元细胞丢失是AD的一个决定性特征,但其潜在机制仍不清楚。比利时VIB-KU鲁汶脑与疾病研究中心Bart De Strooper团队将人类或小鼠神经元异种移植到AD小鼠模型的大脑中,发现只有人类神经元表现出缠结、Gallyas银染、粒细胞杂色神经变性、磷酸化tau血生物标志物和相当大的神经元细胞丢失[2]。长链非编码RNA MEG3在人类神经元中强烈上调。这种神经元特异性长链非编码RNA在AD患者中也上调。单独的MEG3表达就足以在体外诱导人类神经元坏死性凋亡。使用RIPK1、RIPK3或MLKL的药理学或遗传操作下调MEG3并抑制坏死性凋亡,挽救了异种移植人神经元中的神经元细胞丢失(图2)。这些数据表明,坏死性凋亡是病理性tau积累的下游,由非编码RNA MEG3的上调诱导。预防神经元细胞损失的疗法,结合更主流的Aβ和tau靶向干预措施,可能是对当前开发AD疾病缓解策略的有益补充。

图2 抑制坏死性凋亡可防止人体神经元细胞丢失
3. 坏死性凋亡与帕金森病
PD是最具破坏性的神经退行性脑部疾病之一,其特征是黑质(SN)中多巴胺能神经元的进行性丢失和α-突触核蛋白聚集体的沉积。细胞坏死性凋亡执行蛋白MLKL参与多种疾病,然而,它在PD中的确切作用仍不清楚。复旦大学上海工业微生物工程研究中心Jixi Li团队研究了MLKL抑制或消融对毒性α-突触核蛋白预制原纤维诱导的原代神经元细胞和人iPSC衍生的中脑类器官的神经保护作用[3]。使用SNCA A53T突触核蛋白转基因小鼠与Mlkl敲除小鼠杂交产生的小鼠模型(Tg-Mlkl-/-),他们评估了Mlkl缺乏对PD特征进展的影响。Tg-Mlkl-/-与经典的A53T转基因小鼠相比,小鼠的运动症状显著改善,磷酸化α-突触核蛋白表达降低。此外,MLKL缺陷通过抑制小胶质细胞和星形胶质细胞的激活减轻了酪氨酸羟化酶阳性神经元丢失并减轻了神经炎症(图3)。Tg-Mlkl-/- SN的单细胞RNA-seq分析小鼠揭示了独特的细胞类型特异性转录组谱,包括前列腺素D合酶表达下调,表明小胶质细胞减少和神经元死亡抑制。因此,MLKL可能是减少神经炎症和预防PD运动缺陷的关键治疗靶点。
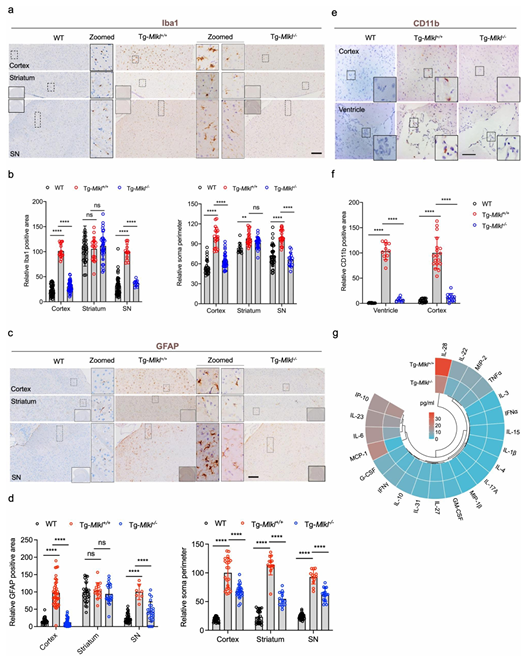
图3 MLKL缺乏减轻A53T转基因小鼠的神经炎症
云克隆不仅可提供多种神经系统疾病动物模型,包括帕金森、阿尔兹海默症、焦虑症、慢性应激抑郁等,涵盖常见神经系统疾病。还可提供多个物种小胶质细胞、神经元细胞等原代细胞产品和各类神经系统疾病、细胞坏死性凋亡检测指标及上述TLR3、IFN等相关产品,可助力广大科研工作者进行坏死性凋亡与神经系统疾病相关研究。
相关动物模型
帕金森病(PD)小鼠模型
建模方法:

阿尔茨海默病(AD)大鼠模型
建模方法:
麻醉大鼠,麻醉后继而固定于脑立体定位仪上。按照大鼠脑立体定位图谱,以前囟为零起点,前囟后3.5mm处为穿刺点,中线右侧旁开2mm,而后牙科钻钻开颅骨,采用微量注射器自脑表面垂直进针3mm,即:(AP=-3.5mm, ML=2.0mm, DV=3.0mm),双侧海马CA1区缓慢匀速注射Aβ1-40各10μg(1μL),留针5min,退针后缝合伤口。造模后3d后,开始尾静脉注射,注射生理盐水,大鼠每只给药100μl/次/d,连续给药21d后,进行水迷宫行为学检测。
参考文献
[1]Liu Z, Garcia Reino EJ, Harschnitz O, et al. Encephalitis and poor neuronal death-mediated control of herpes simplex virus in human inherited RIPK3 deficiency. Sci Immunol. 2023;8(82):eade2860. (IF=17.6)
[2]Balusu S, Horré K, Thrupp N, et al. MEG3 activates necroptosis in human neuron xenografts modeling Alzheimer's disease. Science. 2023;381(6663):1176-1182. (IF=44.7)
[3]Geng L, Gao W, Saiyin H, et al. MLKL deficiency alleviates neuroinflammation and motor deficits in the α-synuclein transgenic mouse model of Parkinson's disease. Mol Neurodegener. 2023;18(1):94. (IF=14.9)