坏死性凋亡与肺部健康:探索未来的治疗策略
细胞死亡被认为是肺损伤发展的驱动因素。作为一种新型程序化细胞死亡方式,坏死性凋亡最近受到了越来越多的科学关注。坏死性凋亡是一种在先天免疫中很重要的免疫原性调节细胞死亡程序,与多种情况下肺损伤的发展有关。其特征是裂解细胞死亡和随之而来的内源性炎症介质的细胞外释放,会引发炎症或引起先天免疫反应,通过释放损伤相关分子模式来保护机体。不同的刺激,包括感染性和无菌性,都可以诱发坏死性凋亡,根据这种反应的背景和持续时间,由此产生的影响可能对宿主具有保护性或病理性影响。越来越多的证据表明,坏死性凋亡与肺部疾病的发生和发展有关,例如肺部感染、急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)、哮喘、慢性阻塞性肺病(COPD)等。因此,坏死性凋亡是未来治疗肺部疾病的可能靶点。
1. 坏死性凋亡阻断可预防重度流感患者的肺损伤
严重的甲型流感病毒(IAV)感染可导致过度炎症、肺损伤和ARDS,目前尚无有效的药物治疗。坏死性凋亡是ARDS和相关炎性疾病治疗干预的一个有吸引力的切入点,因为它在严重IAV感染期间会引发致病性肺部炎症和致死性。美国费城福克斯-蔡斯癌症中心免疫学中心Siddharth Balachandran团队发现一种新开发的受体相互作用蛋白激酶3(RIPK3)抑制剂UH15-38在体内有效和选择性地阻断了IAV引发的肺泡上皮细胞坏死性凋亡(图1)[1]。UH15-38改善了肺部炎症,并预防了感染实验室适应型和流行型IAV后的死亡率,而不会损害抗病毒适应性免疫反应或阻碍病毒清除。UH15-38即使在感染后期也显示出强大的治疗效果,这表明RIPK3阻断可能对IAV驱动的ARDS和其他高度炎症性疾病的患者提供临床益处。
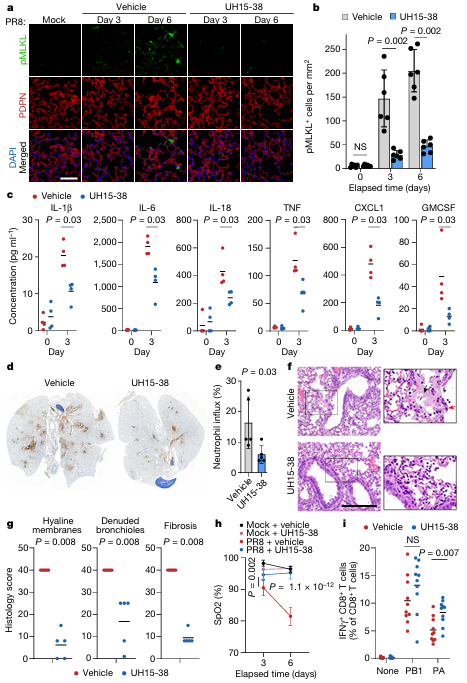
图1 UH15-38可预防IAV感染肺部的坏死性凋亡、炎症和损伤
2. RIPK1激酶依赖性炎症和细胞死亡驱动COPD发病
RIPK1是调节细胞死亡(包括凋亡和坏死性凋亡)和炎症的关键介质,两者都是COPD发病机制的驱动因素。比利时根特大学医院呼吸内科Ken R. Bracke团队确定了RIPK1激酶依赖性细胞死亡和炎症在COPD发病机制中的作用[2]。RIPK1在COPD肺泡1型(AT1)、AT2、纤毛和神经内分泌细胞中的表达增加。与从不吸烟者和没有气流限制的吸烟者相比,COPD患者气道上皮中的RIPK1蛋白水平显著升高。在小鼠中,暴露于香烟烟雾(CS)同样增加了AT2细胞中Ripk1的表达,并进一步增加了肺泡巨噬细胞和T细胞中的Ripk1表达。RIPK1激酶活性的遗传和/或药理学抑制显著减轻了急性和亚急性CS暴露后的气道炎症,以及慢性CS暴露后气道重塑、肺气肿、凋亡和坏死性凋亡(图2)。这些结果表明RIPK1激酶抑制在COPD实验模型中具有保护作用,可能是一种新的有前景的治疗方法。
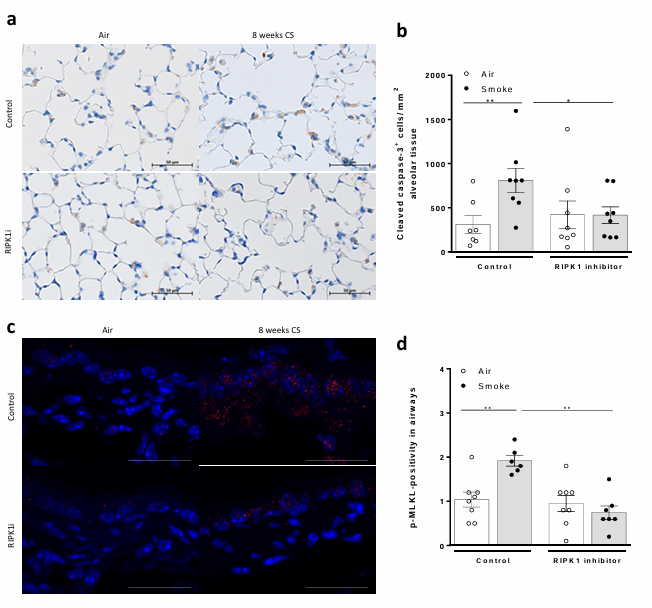
图2 抑制RIPK1激酶活性可减轻慢性CS诱导的RIPK1蛋白激酶依赖性凋亡和坏死性凋亡
3. 抑制坏死性凋亡可增强肺移植物的保护
使用“扩展标准”或“边缘”供体,例如心循环死亡后供体捐献的肺,是解决器官短缺问题的选择之一。然而,要有效的保存策略来减少肺移植物缺血损伤以改善移植后受者预后。英国伦敦切尔西和威斯敏斯特医院Daqing Ma团队旨在确定补充α2-肾上腺素受体激动剂右美托咪啶(Dex)的移植物保存溶液是否通过减少受调节的细胞死亡,特别是坏死性凋亡来保护肺移植物[3]。心脏循环系统死亡后长时间的缺血引发了Rip激酶介导的坏死性凋亡,冷储存损伤和肺移植物损伤加剧了这种凋亡。Dex补充剂通过上调Nrf2激活和减少氧化应激显着减少坏死性凋亡,从而显着改善肺移植物形态(图3)。Dex治疗还减轻了内质网应激,稳定了溶酶体并促进了细胞膜再密封功能,从而减少了A549细胞低温缺氧再氧合后的细胞死亡和炎症激活。这些数据表明,在器官保存溶液中添加Dex可能会减少肺移植物的IR损伤,从而改善移植物功能并减少炎症。
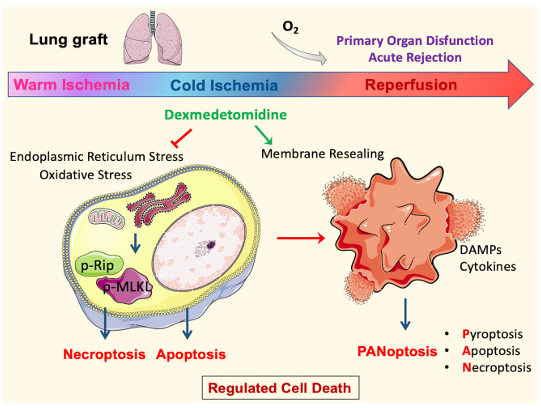
图3 Dex介导的肺移植保护的分子机制
云克隆不仅可提供多种呼吸系统疾病动物模型,包括急性肺损伤、慢性阻塞性肺疾病、哮喘、支气管炎、肺栓塞、肺炎、肺纤维化等,涵盖常见呼吸系统疾病。还具有多个物种肺微血管内皮细胞、肺成纤维细胞、肺泡上皮细胞等原代细胞和各类呼吸系统疾病和坏死性凋亡相关检测指标,可助力广大科研工作者进行呼吸系统疾病与坏死性凋亡相关研究。
相关动物模型
肺纤维化(PF)小鼠模型
模型编号:DSI518Mu01
建模方法:SPF级C57/BL6雌性小鼠,体重约18~20g。使用气管滴注博来霉素法建模。麻醉小鼠,仰卧固定于实验台上,颈部去毛后酒精消毒,切开皮肤,逐层暴露气管,将1mL注射器经两气管软骨环间隙朝向心端刺入气管,回抽无阻力,则注入博莱霉素 5mg/kg/L(对照组注入等量的生理盐水)。手术完毕后迅速将动物直立、旋转,使药液在肺内分布均匀,动物清醒后常规饲养。
模型展示:
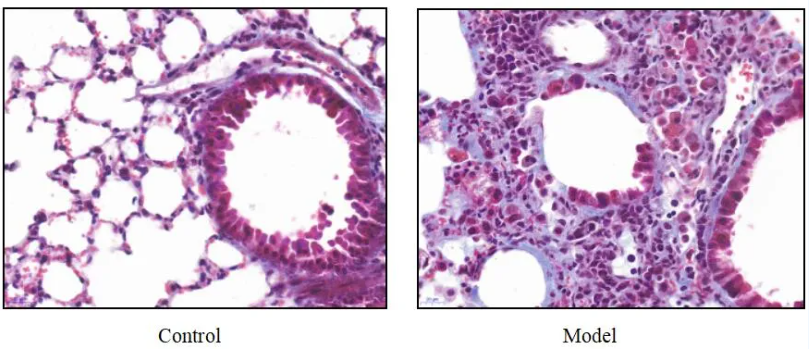
哮喘小鼠模型
模型编号:DSI528Mu01
建模方法:
1.明矾致敏佐剂:10%明矾溶液(溶于双蒸水)2ml与500ug/ml OVA(溶于PBS)2ml等量混合后,用NAOH调PH值为6.5,室温孵育60min,750r/min,离心5min,去掉上清液,重溶于2ml PBS。致敏时每只小鼠腹腔注射200ul,其中含2mg明矾和100ug OVA。
2.致敏:小鼠分别于第0、14天时腹腔注射明矾致敏佐剂0.2ml,对照组注射相同剂量的PBS溶液,正常饮食饲养。
3.激发:雾化吸入,第21天时小鼠放入有机玻璃箱,5% OVA雾化吸入。每天30min,共7d,最后一次致敏后24h内检测。以小鼠出现烦躁不安、呼吸急促、腹肌痉挛等阳性反应作为造模成功的标准。对照组采用PBS雾化吸入,其他操作均相同。
4.末次激发24h麻醉小鼠,摘眼球取血,室温静置2h后于4℃3000r离心10分钟提取血清,放入-80冰箱冻存。取左肺组织于4%多聚甲醛溶液中固定用于病理染色;右肺组织液氮冷冻,-80℃保存用于分生标本。
模型展示:

参考文献
[1]Gautam A, Boyd DF, Nikhar S, et al. Necroptosis blockade prevents lung injury in severe influenza. Nature. 2024;628(8009):835-843. (IF=50.5)
[2]Van Eeckhoutte HP, Donovan C, Kim RY, et al. RIPK1 kinase-dependent inflammation and cell death contribute to the pathogenesis of COPD. Eur Respir J. 2023;61(4):2201506. (IF=16.6)
[3]Chen Q, Liu X, Liu Z, et al. Tackling regulated cell death yields enhanced protection in lung grafts. Theranostics. 2023;13(13):4376-4390. (IF=12.4)