体外研究新法宝,类器官 ——如何跟体内器官更类似?
来源于干细胞的类器官是模拟人类生理的重要模型,并应用于遗传疾病、癌症、再生医学等研究中。但这类类器官不包含在体内稳态和疾病中起重要作用的特化免疫细胞。而肠道免疫功能紊乱可导致各种病理改变,包括持续感染和自身免疫等。虽然来源于干细胞的肠道类器官可以模拟上皮细胞的分化和功能,但由于缺乏组织特异性免疫区室,它们在肠道病理学研究中受限。为了弥补这类缺陷,成人或诱导多能干细胞衍生的类器官已与血源性先天或适应性免疫细胞共培养。然而,这类模型依然没有真正的成人组织驻留淋巴细胞室。
2024年8月14日,有研究团队在《Nature》期刊上发表了题为“Human organoids with an autologous tissue-resident immune compartment”的文章,该研究通过上皮类器官和自体组织驻留记忆T(Autologous tissue-resident memory T,TRM)细胞的自组织形成人肠道免疫类器官(Intestinal immuno-organoids,IIOs),该研究结合IIOs和单细胞转录组学来研究癌症靶向生物制品在患者中引发的肠道炎症,发现炎症与活化CD8+ T细胞群的出现有关,这些细胞逐渐获得上皮内和细胞毒性特征。研究人员通过IIOs将Rho通路确定为缓解免疫治疗相关肠道炎症的新靶点。

以下为研究团队的整体研究思路。
一、通过上皮类器官与TRM细胞的自组织形成IIOs。
该研究通过在类器官中引入TRM细胞从而引入相关淋巴细胞,因为TRM细胞永久驻留在肠黏膜中,是抵御病原体的一线防御,且TRM细胞具有记忆特性。由于人TRM细胞在酶从组织中去除后生存能力较差,研究人员采用了无酶、基于支架的抓取方案来分离肠道免疫细胞。流式细胞术结果显示分离的细胞表达与肠道相关的TRM细胞标志物(包括CD161和CD117),及与组织驻留和上皮细胞整合等相关的表面分子(CD69和CD103等)。研究者从人肠道样本中生成类器官和TRM细胞,还从同一供体收集了对应的外周血单核细胞(PBMCs)。类器官建立后,与TRM细胞或PBMCs在三维细胞外基质中结合。结果发现:虽然PBMCs占据了细胞外基质空间,但与上皮细胞没有明显的相互作用,但TRM细胞亚群浸润类器官在没有刺激的情况下整合在上皮屏障内,类似于肠道内上皮淋巴细胞(Intestinal intraepithelial lymphocytes,IELs)的行为。(见图1)
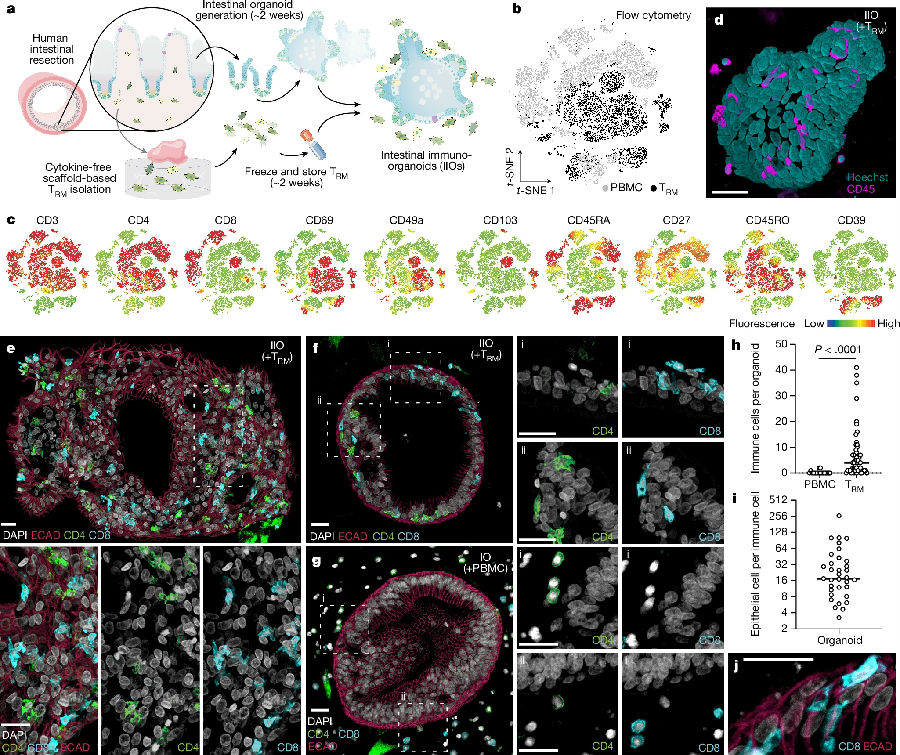
图1. 肠道来源的TRM细胞可动态整合到自体类器官中形成IIOs。
(文中所有图片均来源于《Nature》杂志)
一、结合IIOs和单细胞转录组学来研究T细胞双特异性抗体(Tcell-bispecific,TCBs)对患者肠道炎症的影响。
为了了解TRM细胞和IELs在体外与肠上皮细胞整合的方式,该研究使用单细胞RNA测序分析了来自三种不同小肠样本的IIO培养物。研究表明,单独培养或在IIOs中培养的TRM细胞,与匹配的血源细胞不同,在转录组学上由以下因素定义:(1)缺乏淋巴结归巢所需的受体(SELL、CCR7),(2)肠道归巢和整合因子(ITGA1、CCR9、JAML)本质上高表达,(3)完全缺乏细胞毒性颗粒(GZMB、GZMK、GNLY)。研究人员进一步追踪了供体匹配的肠道TRM细胞和血液T细胞,结果显示了两个种群在形态和迁移行为上的显著差异。血液T细胞大部分是静态和圆形的,但TRM细胞则呈现出细长的形状,并在上皮层和细胞外基质内动态迁移。(见图2)
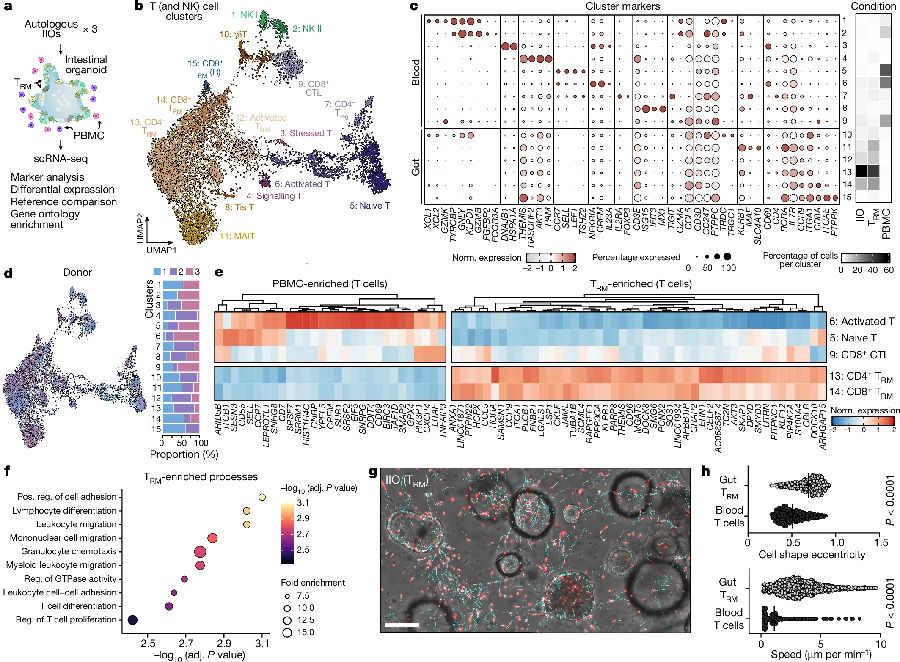
图2. 组织驻留的转录组特征和迁移行为是TRM细胞上皮嵌入和IIOs形成的基础
接下来,研究人员测试了TRM细胞和PBMCs之间的差异转录组和迁移行为是否会转化为效应功能的差异,特别是研究了IIOs与癌症免疫治疗相关的临床毒性及严重的肠道炎症之间的关联。研究人员选择了solitomab(一种T细胞双特异性抗体,抗CD3/EpCAM抗体),旨在通过上皮细胞粘附分子(EpCAM)将活化的T细胞与实体肿瘤交联,从而在患者中诱导侵袭性非故意肠道炎症。该研究用临床相关浓度的EpCAM靶向TCBs处理IIOs。与PBMCs培养的类器官不同,检测caspase 3/7发现IIOs在低至40 pg/ml的浓度下以TCB剂量依赖性的方式靶向,并且在处理后8小时即可靶向。进一步研究结果表明相对于非靶向对照,TCB处理诱导T和B细胞状态的比例发生变化。在第4小时特别突出的是TH1样CD4+T群体,特征是TNF和IFNG信号的快速诱导,随着时间的推移而下调。在48小时,观察到活化的CD8+ IEL群体的出现,表达与细胞毒性(如GZMB)、TCR信号传导和T细胞迁移相关的基因。同时,出现了(表达MKI67的)循环CD4+T细胞群和活化的B细胞群,而调节性T细胞群减少。且通过流式细胞术检测,发现scRNA-seq检测到的关键基因表达变化与蛋白水平的变化一致。这些结果显示IIO细胞异质性动力学与从经历自发和免疫检查点抑制剂(ICI)诱导的肠道炎症的患者中观察到的原始样本具有惊人的相似性。这些相似之处表明IIOs可用于体外研究肠道炎症。(见图3)
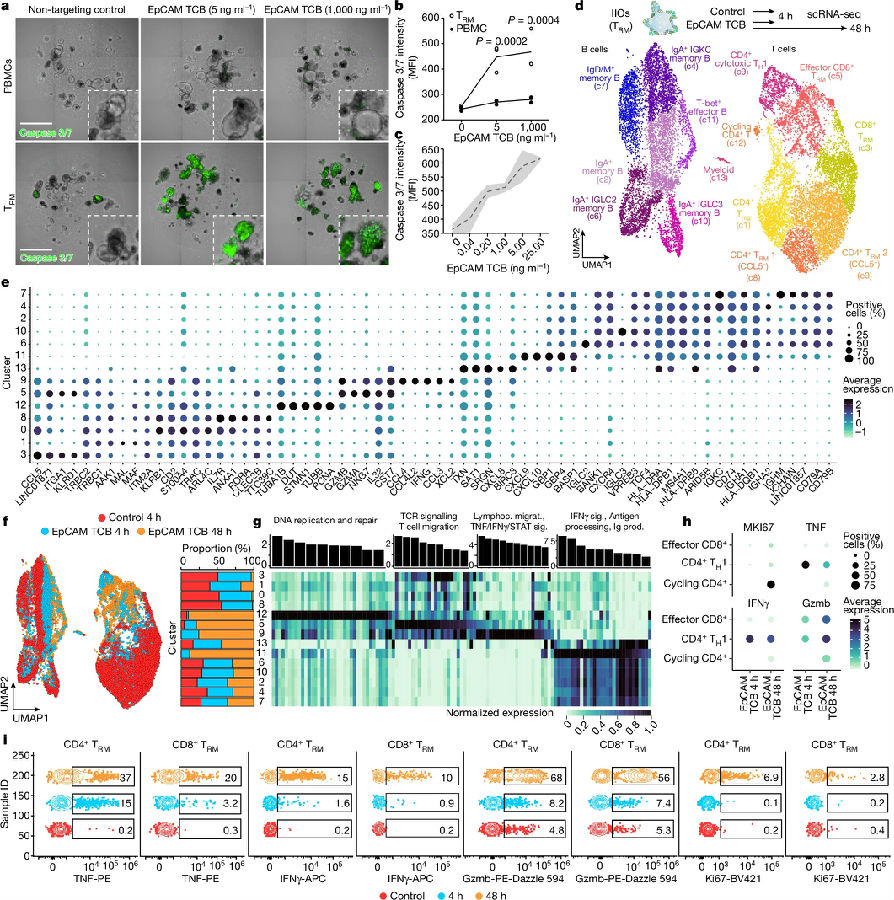
图3. IIOs再现了与TCBs相关的临床肠道炎症
三、探究Rho通路对IIOs模型中炎症的影响。
鉴于TNF阻断抗体在自身免疫性疾病治疗中的有效性,以及在模型中TNF的早期诱导,研究人员研究了其在促进分化和激活中的作用。预测从IIOs中完全去除TNF将阻止TRM细胞活化。TCB治疗后,在IIOs中使用阿达木单抗(adalimumab)对TNF进行抗体中和证实了这一预测,处理后显著降低了TRM细胞中关键激活和分化标志物ICAM-1、4-1BB、CD25和Gzmb的表达。此外,在炎症反应中上皮表达的趋化因子CCL2显著降低。鉴于TRM细胞在细胞外基质内的快速运动,研究人员假设T细胞的运动可能与炎症关联。为了验证这一假设,该研究使用ROCK1/2(Rho-associated protein kinase 1/2)抑制剂Y-27632来抑制TCB处理的IIOs细胞的运动。发现ROCK抑制比TNF阻断更有效地减少了上皮细胞凋亡,同时抑制TRM细胞运动,并诱导T细胞激活标记物和细胞溶解分子,如perforin和Gzmb。细胞内染色显示TNF的诱导也被抑制,但总体T细胞活力不变。由此研究人员将Rho通路确定为缓解免疫治疗相关肠道炎症的新靶点。(见图4)

图4. 转录组学分析阐明TCB介导的炎症背后的免疫动力学
综上,该研究使用IIOs确定了通过Rho通路阻断TRM细胞运动有助于抑制炎症。由于IIOs重现了表型结果和介导它们的细胞间相互作用,由此推测,IIOs不仅可以帮助研究药物诱导炎症的的组织驻留免疫反应,还可以助力研究包括肿瘤发生、感染性和自身免疫性疾病下的组织驻留免疫反应。
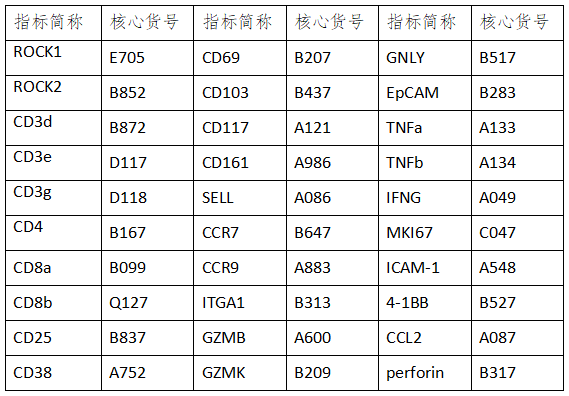
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/