衰老如何致癌,慢性炎症是关键
年龄是癌症的一个主要危险因素,但衰老如何影响肿瘤仍不清楚。2024年9月,西奈山伊坎医学院的研究团队在《Science》发表题为“Hematopoietic aging promotes cancer by fueling IL-1⍺–driven emergency myelopoiesis”的研究。在这个研究中,研究人员确定了衰老免疫系统驱动癌症进展,造血系统的老化增强了紧急的骨髓生成,导致肿瘤中髓系祖细胞样细胞(MPs)的局部积累。IL-1⍺是促进衰老增强的急性髓系祖细胞样细胞生成的关键驱动因素,它促进了衰老增强的紧急骨髓生成反应,在肿瘤发展早期使用抗IL-1α抗体阻断不仅可以减缓肺肿瘤的生长,还可以使老年小鼠的紧急骨髓生成正常化。研究还发现造血系统的衰老是通过下调与年龄相关的DNA甲基转移酶3A(DNMT3A)增强IL-1α的产生,在肿瘤发展的早期破坏IL-1R1信号,使骨髓生成正常化,并减缓了肺、结肠和胰腺肿瘤的生长。阐明了衰老如何促进癌症,并提供了可操作的治疗策略。

1. 衰老肺组织肺泡巨噬细胞(AMs)损耗
为了探讨年龄对肺癌发生发展的影响,研究人员用7周龄和72周龄小鼠作为研究对象,发现老年鼠肺泡细胞密度降低且血管渗透入肺实质增加。随后研究了肺衰老的指标并测量了参与免疫监测的细胞,老年肺中的树突状细胞(DCs)和效应淋巴细胞(包括肺组织中NK细胞、血液中CD8+和CD4+ T细胞)显著减少。由于肺功能的保存依赖于组织驻留的AMs,接下来选择研究它们是如何受到衰老影响的。通过流式细胞术观察到老年肺中AMs的绝对数量显著下降,且AMs的下降主要是由于胚胎AMs的丢失,而成年单核细胞来源的AMs的数量没有重大变化,这与对其他衰老组织中组织驻留巨噬细胞的类似分析一致,且老年鼠循环(外周血和骨髓)AMs伴随损耗表明自我更新能力下降。这些数据表明,老年鼠AMs的自我更新能力较差,并在衰老过程中,稳定状态的骨髓生成不能重新填充随着时间而失去的AMs。
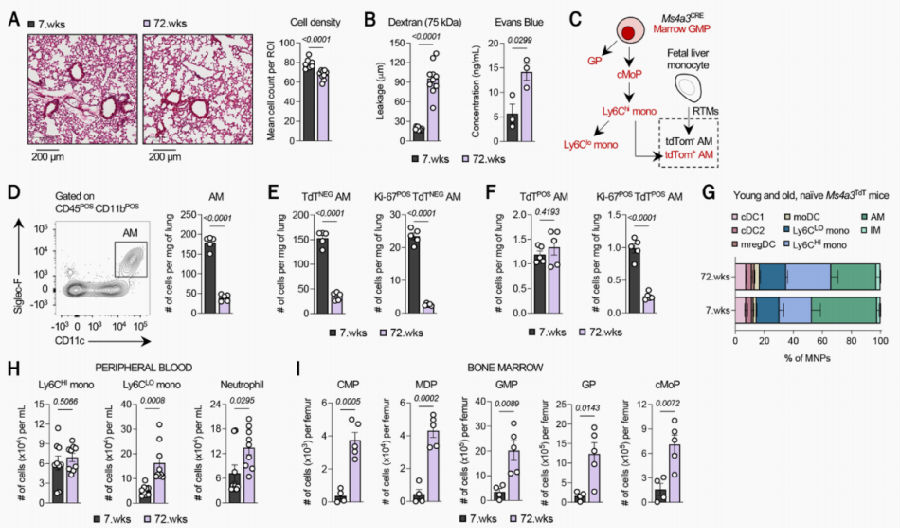
图1. 年龄与组织驻留的AMs的损耗有关
2. 老年鼠肺癌进展更快
假设当肿瘤发生过程中发生炎症时,与年轻小鼠相比,老年鼠可能会产生更放大的紧急骨髓生成反应,并在肿瘤微环境(TME)中遭受更大的髓细胞负担。为了验证这一假设,首先观察衰老如何塑造TME并影响肺肿瘤生长,研究人员使用的非小细胞肺癌(NSCLC)模型小鼠是基于肺中KrasG12D/+ Trp53-/- Rosa26A3Bi Rag1-/-细胞(KPARs)的移植和原位生长,该模型能够专门评估宿主小鼠的衰老对肿瘤生长的影响。研究发现,老年鼠肿瘤生长更快,在肿瘤进展后期表现出更大的肿瘤负担且生存率明显降低。随后设计了一种异体慢性骨髓移植(BMT)来分析衰老肺TME的免疫和非免疫生态系统对宿主肺癌生长的影响,在BMT移植8周后,小鼠接种KPARs,并在接种后10天和20天评估肿瘤负荷,结果发现,衰老的免疫系统加速了癌症生长。更值得注意的是,让免疫系统恢复年轻可以显著降低衰老小鼠的癌症生长,且具有年轻骨髓的老年小鼠的荷瘤肺中肺MPs、单核-巨噬细胞(mo-macs)和中性粒细胞(NeuP)数量减少。这些数据表明,造血功能的衰老足以通过增强肿瘤诱导的紧急骨髓生成来促进肺癌的进展,是肺癌进展的主要驱动力。
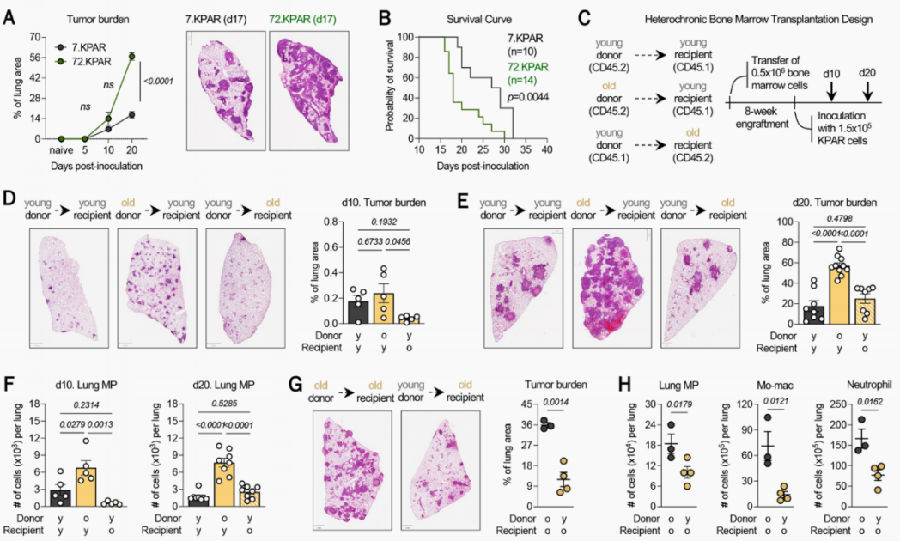
图2. 衰老的造血功能是肺癌进展的主要驱动力
3. IL-1⍺特征定义了老年鼠荷瘤肺中的MPs
这些发现促使研究人员进一步表征年轻和老年鼠肺TME的免疫细胞,利用scRNAseq技术对来自年轻和老年鼠荷瘤肺组织分选的33,572个CD45+ 细胞进行分析,以构建肺TME的单细胞图谱,结果表明骨髓细胞对老年鼠肺癌生长的促进作用。同时,研究人员还对肺MPs中的细胞群进行了鉴定分析,其包括了NeuP、粒细胞(GranuloP)和单核细胞祖细胞 (MonoP)。发现老年鼠肺MPs显示出更多的未成熟特征,老年鼠肺肿瘤中的单核细胞也显示出较少成熟的标志,这表明衰老可能促进了未成熟髓系细胞的积累。大部分的肺MPs是单核细胞,因此将研究重点缩小到MonoP,发现MonoP显著增多,且表达更高水平的IL-1⍺,IL-1β在所有肺MPs和mo-macs中广泛表达。通过ELISA进一步证实了在老年鼠的荷瘤肺中,IL-1⍺和IL-1β的蛋白水平均被显著上调。
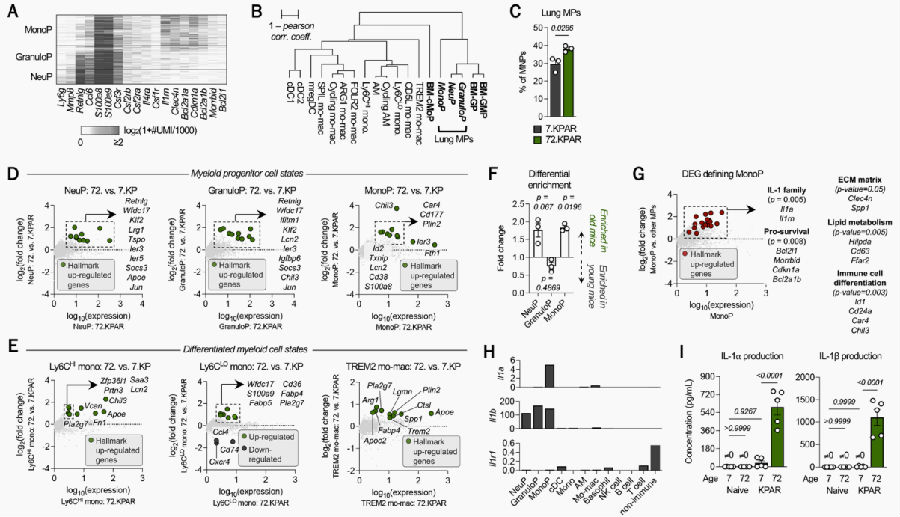
图3. IL-1⍺特征定义了老年鼠荷瘤肺中的MPs
4. 阻断IL-1⍺:IL-1R1信号通路可延缓肺癌的进展
研究人员对细胞群进行分析后发现肺肿瘤中肺MPs产生最多的IL-1⍺,而IL-1β则主要由NeuP产生,尤其是老年鼠IL-1⍺和IL-1β的增加比年轻鼠更为显著,表明造血衰老提高了它们的产生。基于以上数据,研究人员对IL-1⍺或IL-1β进行基于抗体的阻断,并将其阻断后的效果与IL-1R1拮抗剂(anakinra)进行比较,anakinra同时干扰IL-1⍺和IL-1β的信号传导。在接种肿瘤细胞24小时后开始治疗,IL-1⍺阻断比IL-1β阻断更能延迟肺癌进展,值得注意的是,两者联合使用在减少肿瘤生长方面表现出明显的协同效应,这与anakinra治疗效果相当,并且anakinra治疗明显提高了肺癌鼠的生存率。
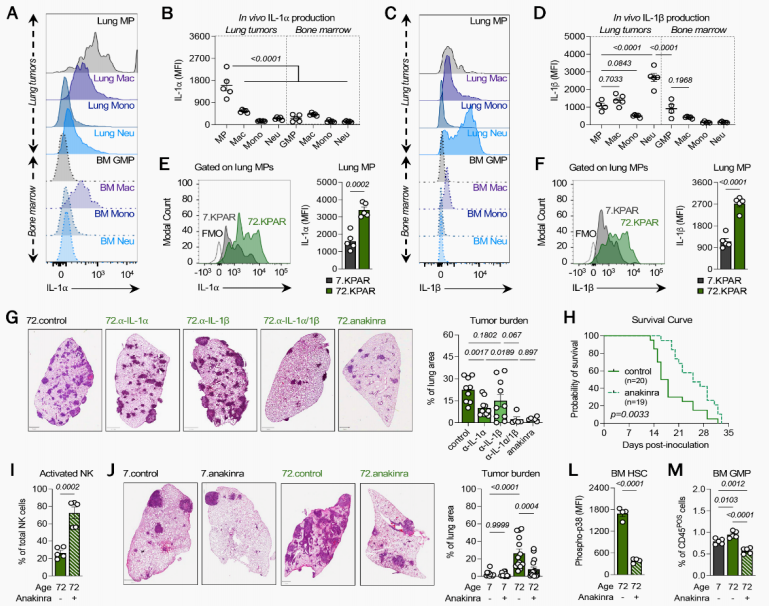
图4. 阻断IL-1⍺:IL-1R1信号通路可延缓肺癌的进展
5. 在造血功能衰老过程中,DNMT3A的下降增强了IL-1⍺的产生
鉴于IL-1⍺的转录是肺组织中的MPs触发的,研究人员尝试研究在TME中肺MPs产生这种反应的原因,发现老年鼠单核细胞和骨髓祖细胞暴露于凋亡的肿瘤细胞碎片中比年轻鼠的这些细胞产生更高的IL-1⍺,这些数据说明细胞碎片可以诱导IL-1⍺的产生,造血衰老改变了单核细胞及MPs细胞内在表型,使其易于产生更多的IL-1⍺。对来自年轻和年老鼠骨髓的造血干细胞(HSCs)的bulk RNA-seq分析以识别与衰老相关的转录差异,发现老年鼠HSCs中DNMT3A的表达显著下降。并检测了无癌、健康的年轻和老年人以及NSCLC患者血液循环造血干细胞和祖细胞(HSPC)中的DNMT3A水平,这些数据表明紧急造血功能的程度随着年龄的增长而增加,并证实了与年龄相关的DNMT3A水平的下降,甚至在癌症患者中也是如此。研究团队在年轻和老年鼠的骨髓单核细胞上使用了一种高度特异性和有效的DNMT3A小分子抑制剂,观察到用DNMT3A抑制剂处理和低剂量LPS刺激后,年轻和年老单核细胞的IL-1⍺和IL-1β的产生显著增加,并且用DNMT3A抑制剂处理的年轻单核细胞产生的IL-1水平与未处理的年老单核细胞相当。
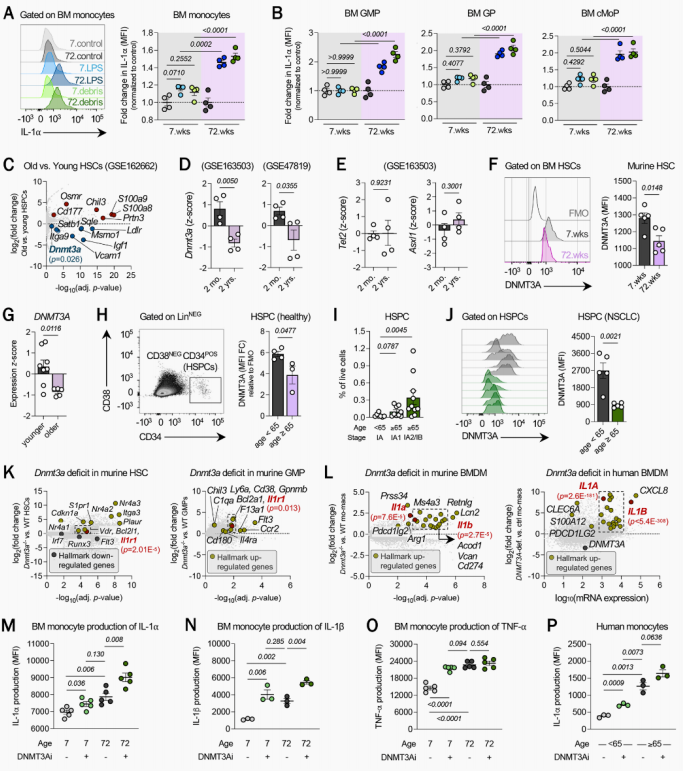
图5. 髓系细胞的衰老导致DNMT3A缺失并促进IL-1⍺的表达
6. IL-1⍺可作为癌症患者衰老和预后的标志物
接下来,研究团队试图探索肺癌的潜在治疗相关性。PD-1阻断仍然作为NSCLC的一线治疗方式,发现anakinra联合PD-1阻断治疗可以显著提高肿瘤的清除率并显著提高细胞毒CD8 T细胞的反应,通过scRNAseq鉴定的主要免疫细胞类型中,发现IL1⍺和IL1β mRNA在CD14单核细胞和mo-macs中检测到最高的表达,与NSCLC患者的正常组织相比,IL1⍺ mRNA mo-macs在原发性切除的肿瘤组织中显著富集。这些数据支持了IL-1⍺ mRNA作为一种与年龄相关的肿瘤、分子特征的研究。研究团队采集了在癌症诊断前三年的血液样本,并比较了癌症患者和吸烟、年龄匹配的对照组1000多种蛋白质的丰度水平,发现IL-1⍺和IL-1β都预示着癌症风险升高。
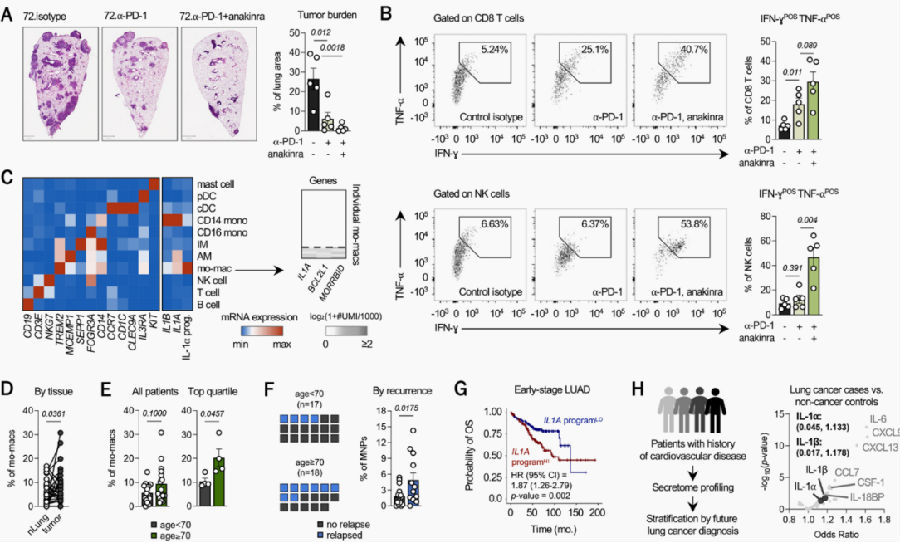
图6. IL-1⍺可作为癌症患者衰老和预后的标志物
云克隆开发了与该研究相关的靶标产品,部分靶标节选如下:
指标名 | 核心货号 | 指标名 | 核心货号 |
IL1a | A071 | IL1b | A563 |
CD4 | B167 | CD8a | B099 |
CD8b | Q127 | Ki-67 | C047 |
CD45 | B030 | CD11b | B685 |
CD3e | D117 | CD3d | B872 |
CD34 | B959 | Sca1 | A514 |
c-Kit | A121 | CD135 | A039 |
CD115 | B484 | Trem2 | G628 |
Csf3r | B476 | Csf2ra | B487 |
Klf4 | B241 | Mmp8 | A103 |
Ccl6 | B060 | S100a8 | B792 |
S100a9 | B793 | TNF-⍺ | A133 |
Ler3 | G249 | Flt3 | A039 |
Txnip | B162 | Socs3 | B684 |
Prtn3 | B434 | Lcn2 | B388 |
TLR4 | A753 | IL-1R1 | A066 |
p53 | A928 | Smad4 | B925 |
Ptf1a | C738 | DNMT3A | J245 |
PD1 | A751 | Cdkn1a | E624 |
Itga3 | B289 | S1pr1 | C937 |
Runx3 | D749 |