肝细胞死亡的新视角:坏死性凋亡与肝病治疗
肝脏是一个复杂的重要器官,负责代谢过程、蛋白质合成以及清除毒素和外源性物质。肝损伤按持续时间分为急性和慢性。最极端形式的急性损伤导致急性肝衰竭;慢性肝损伤是炎症或细胞内应激反应引起的长期和持续的肝损伤和肝炎的结果,包括脂肪性肝炎、自身免疫性肝炎、原发性胆汁性胆管炎和慢性病毒性肝炎。急性和慢性肝损伤导致肝细胞死亡。控制肝细胞死亡作为一种肝脏疾病治疗策略至关重要。坏死性凋亡受到越来越多的关注,并作为最近发现的一种不同于坏死和细胞凋亡的细胞死亡模式被广泛研究。研究表明,坏死性凋亡信号通路在肝脏疾病发作、进展和预后的生理控制中至关重要。因此,进一步分析坏死性凋亡在肝脏疾病中的作用可能为治疗干预提供新的机会。
1. 肝细胞中RIPK3的表观遗传沉默可抑制MLKL介导的坏死性凋亡从而阻止肝脏病变
坏死性凋亡是一种高度炎症性的细胞死亡模式,与肝损伤包括脂肪性肝炎/非酒精性脂肪性肝炎(NASH)有关。然而,支持这些说法的证据一直存在争议。澳大利沃尔特和伊丽莎•霍尔医学研究所Marc Pellegrini试图确定坏死性凋亡在肝脏病理学中的作用和相关性[1]。与对照组动物相比,在缺乏必需坏死性凋亡效应蛋白MLKL的小鼠中观察到相同的感染动力学和病理结果。当喂食高脂肪饮食以诱导NASH时,缺乏MLKL的小鼠与野生型小鼠无法区分。此外,在所有测试条件下,均不能诱导肝细胞坏死性凋亡。他们进一步对RIPK3进行了DNA甲基化测序来研究相关机制。结果表明,在小鼠和人类原代肝细胞中,RIPK3的启动子区域被高度甲基化沉默,从而导致坏死性凋亡无法发生(图1)。总的来说,这项工作支持小鼠和人类的肝细胞转录抑制RIPK3并预防坏死性凋亡的观点。
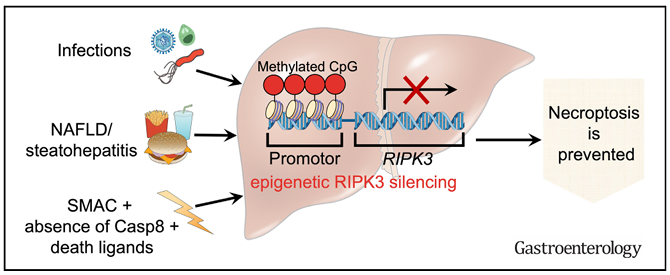
图1 肝细胞中RIPK3的表观遗传沉默抑制坏死性凋亡
2. NASH中的CD47-SIRPα轴阻断促进肝巨噬细胞清除坏死性凋亡性肝细胞并减轻肝纤维化
坏死性凋亡导致NASH的肝细胞死亡,但坏死性凋亡肝细胞(necHCs)在NASH中的命运和作用仍然未知。美国纽约哥伦比亚大学欧文医学中心医学系Ira Tabas团队发现necHCs在人和小鼠NASH肝脏中的积累,与necHCs上“别吃我”配体CD47的上调有关,并与肝巨噬细胞上CD47受体SIRPα的增加有关,这与巨噬细胞介导的对necHCs清除的受损一致[2]。在两种饮食诱导的NASH小鼠模型中,使用抗CD47、抗SIRPα,或使用腺相关病毒递送的shCD47来抑制CD47表达,结果显示肝脏细胞中的CD47被抑制,促进了肝巨噬细胞对necHCs的清除,降低了肝星状细胞激活标志物和肝纤维化(图2)。这些结果提示了阻断CD47-SIRPα轴,是减少NASH肝脏necHCs积累和抑制肝纤维化进展的一种治疗策略。
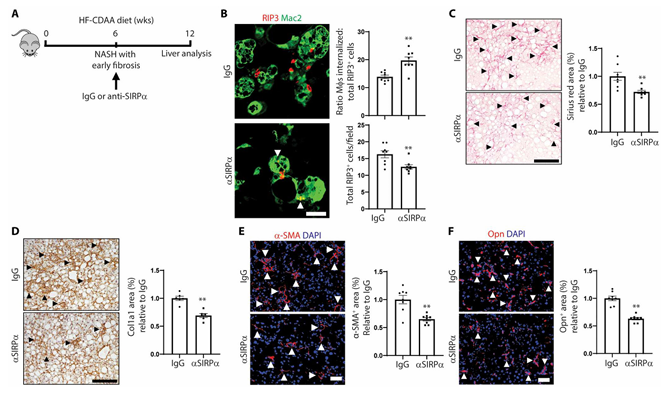
图2 抗SIRPα增加早期NASH小鼠necHC吞噬并改善肝纤维化
3. 转录因子ATF3将肝脂肪变性的细胞死亡从凋亡转变为坏死性凋亡
肝细胞死亡随着肝脂肪变性的加重而增加,尽管其调控机制尚不清楚。日本金泽大学前沿科学倡议研究所代谢与营养研究中心Hiroshi Inoue团队发现肝脂肪变性加重将肝细胞死亡模式从凋亡转变为坏死性凋亡,导致肝细胞死亡增加[3]。他们的研究结果表明,转录因子ATF3通过诱导坏死性下垂调节因子RIPK3的表达,在这一转变中起着主调节作用。在严重的肝脂肪变性中,部分肝切除术后,肝脏ATF3缺陷或过表达小鼠分别表现出RIPK3表达和坏死性凋亡减少或增加。活细胞成像显示,在培养的肝细胞中,ATF3将TNFα依赖的细胞死亡模式从凋亡转变为坏死性凋亡(图3)。在NASH小鼠中,肝ATF3缺乏抑制RIPK3表达和肝细胞死亡。这种ATF3依赖性RIPK3诱导和激活机制可以成为脂肪变性诱导的肝损伤的治疗靶点。

图3 ATF3将肝细胞凋亡转化为坏死性凋亡
云克隆不仅可提供多种肝脏疾病动物模型,包括肝纤维化、肝缺血、酒精性肝病、肝内胆汁淤积、肝硬化、脂肪肝、肝功能衰竭等,涵盖常见肝脏疾病。还具有还具有多个物种肝星形细胞、肝窦内皮细胞、肝巨噬细胞、肝间充质干细胞等原代细胞产品和肝脏疾病常用检测指标及上述CD47、SIRPα、ATF3等相关产品,可助力广大科研工作者进行肝脏疾病与坏死性凋亡研究。
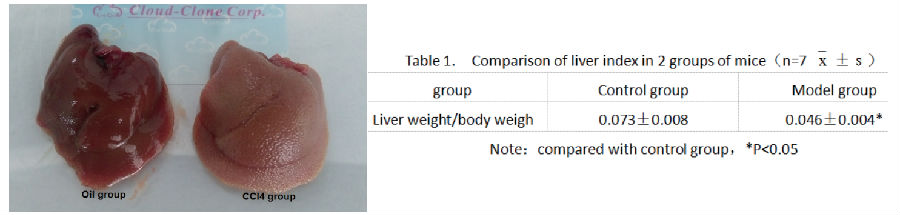
肝纤维化(HF)小鼠模型
建模方法:
按5ml/kg体重皮下注射体积分数为20%CCl4的油剂溶液(CCl4:橄榄油 =1:4), 每3天1次,连续6周。对照组动物皮下注射等量等次的橄榄油溶剂。正常饮食饲养,观察动物活动、精神状况和饮食量 , 实验前后称量小鼠体重。
完成持续给药6周后,称体重,麻醉小鼠,摘眼球取血,室温静置2h后于4℃, 3000r离心10分钟提取血清,放入-80℃冰箱冻存。同时取肝左叶组织 1.5cm×1cm×0.2cm 于 10% 中性福尔马林中固定,石蜡包埋;其余肝组织液氮或者-80℃冷冻保存。
肝缺血(HI)小鼠模型
建模方法:
1. 小鼠术前12h禁食,自由饮水。
2. 麻醉小鼠,麻醉成功后将小鼠平躺在手术台上胶带固定四肢,将小鼠腹部术去毛,用碘酒和75%乙醇术区消毒。
3. 取腹正中切口 1cm,打开腹腔,小心分离出肝脏供血的门静脉和肝动脉。
4. 用无创血管夹夹闭门静脉和肝动脉,0.5min 后,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将小鼠放在37℃恒温加热垫上保温。
5. 完成持续缺血60min后,重新打开腹腔,迅速取出血管夹,恢复缺血肝血流,0.5min左右可见缺血区肝脏由白色逐渐恢复为鲜红色表明再灌注成功,逐层缝合腹腔肌肉和皮肤关闭腹腔,完成手术。待小鼠清醒后放回饲养室饲养,密切关注小鼠的状态及生存状况并做好记录。
参考文献
[1]Preston SP, Stutz MD, Allison CC, et al. Epigenetic Silencing of RIPK3 in Hepatocytes Prevents MLKL-mediated Necroptosis From Contributing to Liver Pathologies. Gastroenterology. 2022;163(6):1643-1657.e14. (IF=25.7)
[2]Shi H, Wang X, Li F, et al. CD47-SIRPα axis blockade in NASH promotes necroptotic hepatocyte clearance by liver macrophages and decreases hepatic fibrosis. Sci Transl Med. 2022;14(672):eabp8309. (IF=15.8)
[3]Inaba Y, Hashiuchi E, Watanabe H, et al. The transcription factor ATF3 switches cell death from apoptosis to necroptosis in hepatic steatosis in male mice. Nat Commun. 2023;14(1):167. (IF=14.7)