星形胶质细胞LRP1通过抑制ARF1乳酸化缓解脑缺血中风
急性脑缺血中风是全世界发病率和死亡率最高的疾病之一,可造成毁灭性和永久性的神经损伤。在中枢神经系统中,星形胶质细胞-神经元细胞间的线粒体传递对于维持神经元细胞的有氧呼吸和能量供给具有重要的意义。低密度脂蛋白受体相关蛋白-1(Low density lipoprotein receptor related protein-1,LRP1)是一种内吞/信号细胞表面受体,调节多种细胞功能。前期研究表明,LRP1与神经退行性疾病的发病机制有关,但其在大脑中的确切功能尚未有统一定论。因此,LRP1是否参与维持大脑稳态以及如何发挥作用还有待明确。最近,西南医科大学附属医院在《Cell Metabolism》上发表了题为“Astrocytic LRP1 enables mitochondria transfer to neurons and mitigates brain ischemic stroke by suppressing ARF1 lactylation”的文章,研究报道了星形胶质细胞LRP1通过减少乳酸的产生和囊泡运输蛋白ADP核糖基化因子1(ADP ribosylation factor 1,ARF1)的乳酸化来促进星形胶质细胞到神经元的线粒体转移,这一过程可以拮抗缺血所造成的器官损伤。
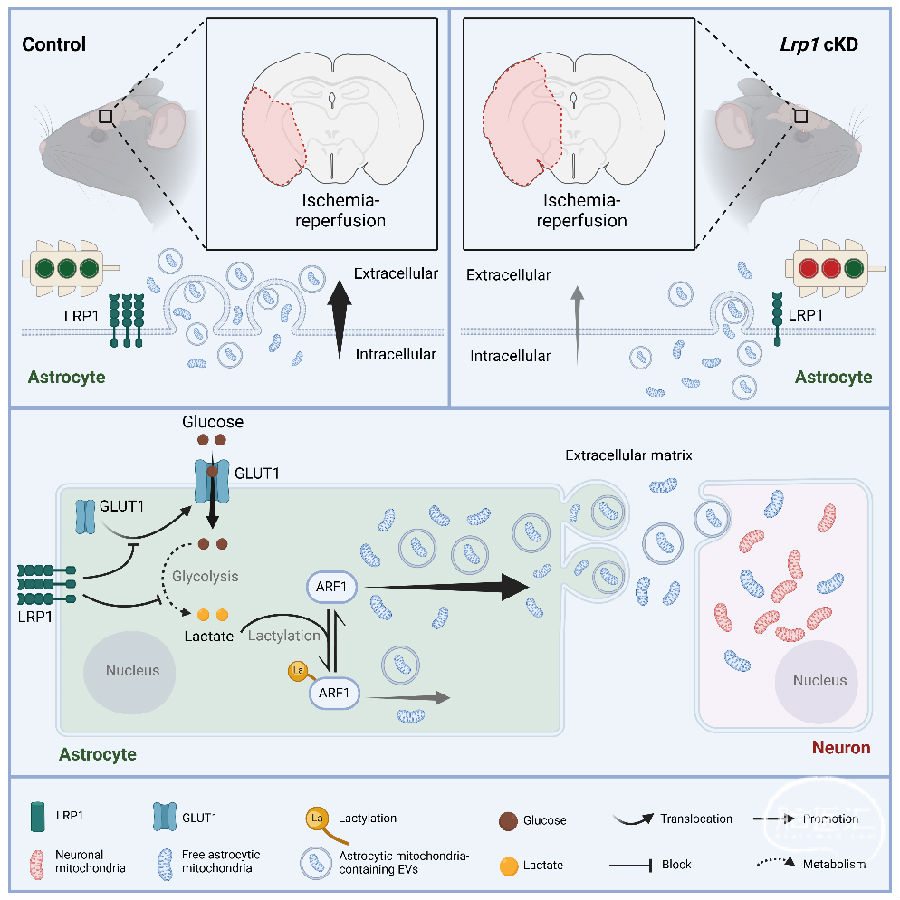
作者首先证明了星形胶质细胞可以释放健康的线粒体并将其转移到邻近的神经元。随后,为了检验星形胶质细胞LRP1是否影响线粒体的释放和转移,研究者敲低了小鼠星形胶质细胞中的Lrp1基因,在新鲜培养基中培养24h后收集星形胶质细胞条件培养基(Astrocyte-conditioned medium,ACM)。与对照组相比,Lrp1基因敲低减少了细胞外线粒体的数量,并伴有线粒体功能下降,包括耗氧量和ATP产生减少。接下来,研究者从mitoSypHer标记的星形胶质细胞中分离细胞外线粒体,并将其添加到小鼠HT22海马神经元中。荧光显微观察证实,与对照组相比,Lrp1缺失的ACM细胞外线粒体处理的神经元中mitoSypHer标记的线粒体较少,这表明Lrp1敲除减少了线粒体向神经元的转移。此外,在神经元-星形胶质细胞共培养24h后,在对照神经元中观察到更多的线粒体,而在与Lrp1缺失的星形胶质细胞共培养的神经元中则没有。由此可见,星形胶质细胞中Lrp1的缺失降低了共培养神经元的线粒体ATP生成和氧消耗率(OCR)。总的来说,这些结果表明星形胶质细胞LRP1促进线粒体从星形胶质细胞转移到邻近的神经元。
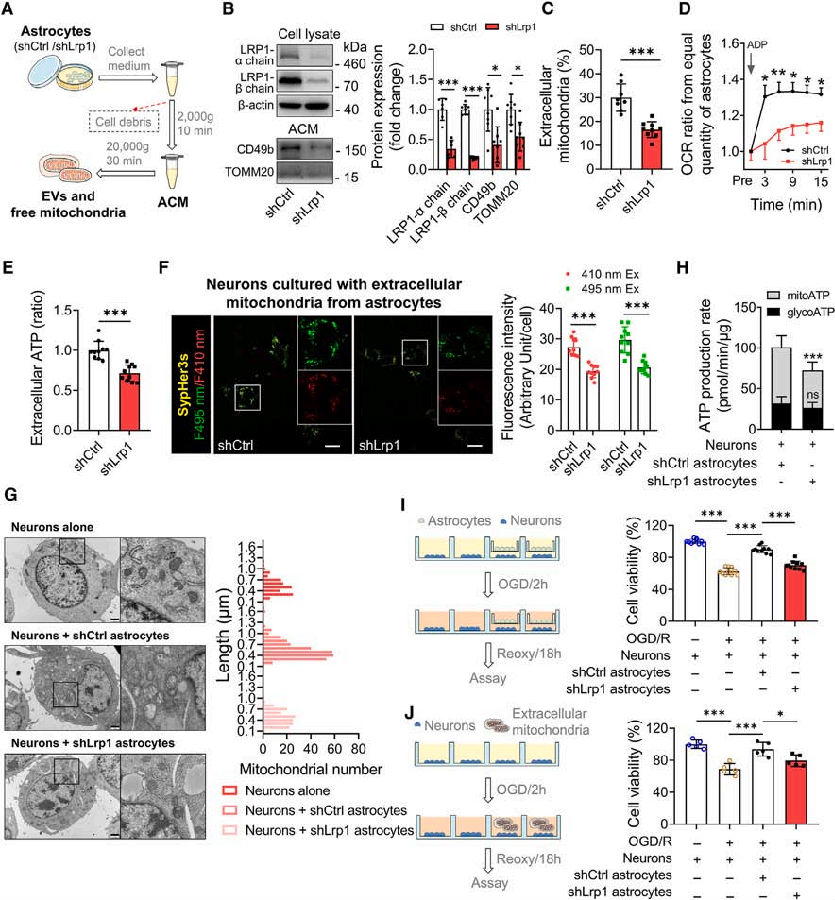
图1. 星形胶质细胞LRP1促进星形胶质细胞到神经元的线粒体转移
(图片来自《Cell Metabolism》)
线粒体在细胞能量代谢中起核心作用。为了探索LRP1介导的线粒体转移的代谢机制,研究者们对表达shCtrl或shLrp1的星形胶质细胞进行了靶向代谢组学分析。结果观察到,在Lrp1缺失的星形胶质细胞中,细胞内葡萄糖和糖酵解中间体甘油醛3-磷酸和乳酸增加。随着糖酵解和三羧酸循环(TCA)代谢物的积累,与shCtrl组相比,shLrp1组星形胶质细胞的OCR和细胞外酸化率(ECAR)均升高。此外,Lrp1敲低的星形胶质细胞的ECAR/OCR比率和ATP生成速率也显著增加,表明糖酵解相对于氧化磷酸化增强。
接下来,研究者通过13C示踪实验进一步研究Lrp1基因敲低星形胶质细胞乳酸水平升高的原因。分别用[U-13C]葡萄糖、[U-13C]L-谷氨酰胺或[U-13C]乙酸标记星形胶质细胞,并分析了13C随后整合到乳酸和TCA循环代谢产物中的情况。结果表明,大部分乳酸是由葡萄糖产生的,Lrp1敲低增加了星形胶质细胞中乳酸的产生。这些结果表明星形胶质细胞Lrp1敲低通过糖酵解产生更多的乳酸。
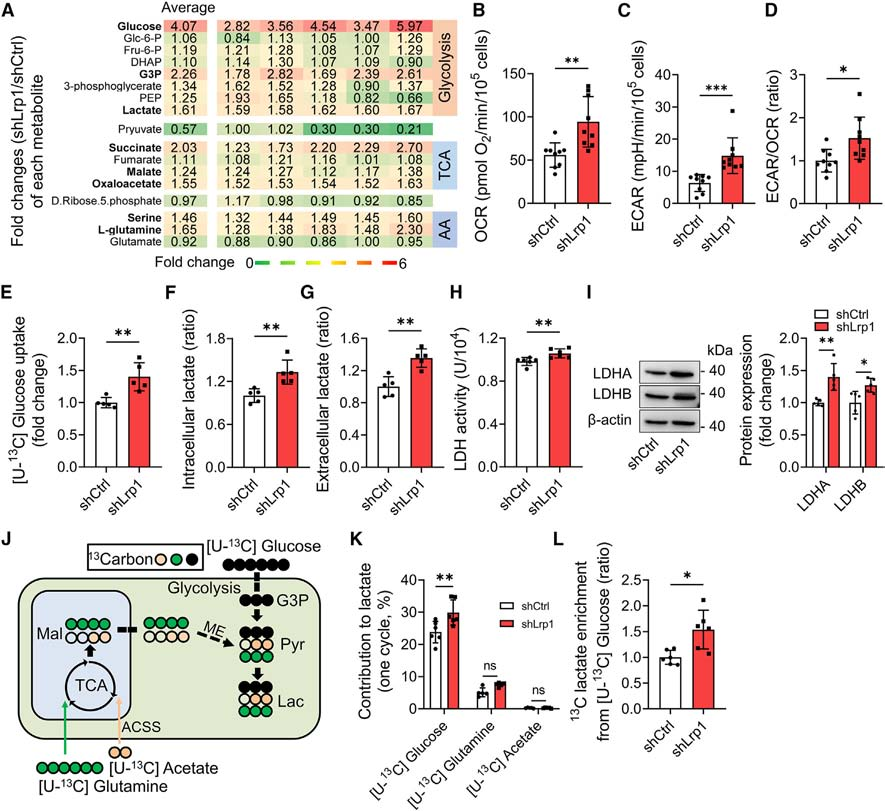
图2. Lrp1敲低促进星形胶质细胞的糖酵解和乳酸代谢
(图片来自《Cell Metabolism》)
随着乳酸的增加,研究者观察到接受shLrp1治疗的星形胶质细胞中整体蛋白赖氨酸乳酸化(Kla)水平升高。为了测试ARF1-Kla73是否是线粒体释放的关键介质,将ARF1的Lys73突变为精氨酸(K73R),从而阻止了乳酸化修饰。结果显示,K73R转染的细胞中ARF1活性受到抑制,线粒体释放上调。相比之下,K73突变为谷氨酰胺(K73Q),模拟了乳酸化,导致ARF1的激活和线粒体释放的进一步抑制。这些发现表明乳酸通过ARF1-Kla73降低星形胶质细胞的线粒体释放。
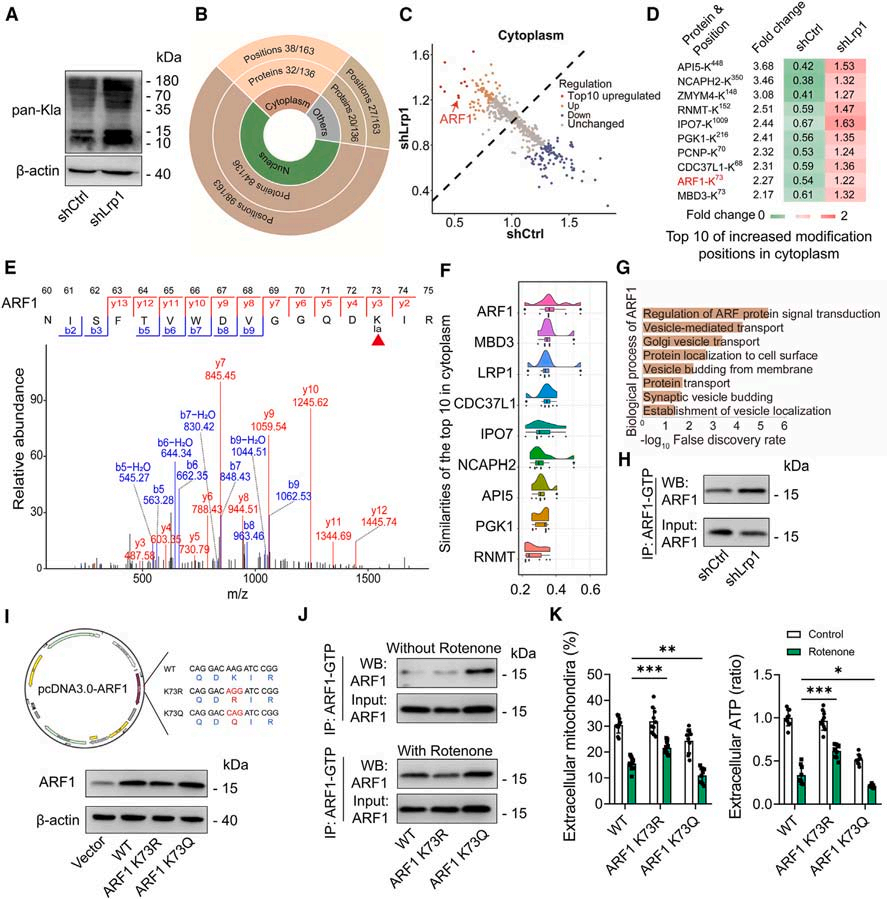
图3. ARF1-K73乳酸化介导lRP1诱导的线粒体释放
(图片来自《Cell Metabolism》)
接下来,作者验证了LRP1诱导的线粒体转移是否能保护脑缺血损伤。敲除C57BL/6J雄性小鼠星形细胞中的Lrp1。结果表明,Lrp1条件敲低(cKD)小鼠表现出大脑中葡萄糖摄取增加和乳酸水平升高,从而导致脑脊液(CSF)中星形胶质细胞线粒体减少。通过共聚焦显微镜和活体双光子成像证实,Lrp1敲低导致神经元中星形胶质细胞来源的线粒体减少。大脑中动脉闭塞(MCAO)手术后,Lrp1 cKD小鼠脑梗死区域明显增大,提示LRP1对脑缺血损伤具有保护作用。此外,通过改进的Bederson神经评分,水迷宫和旷场测试发现,Lrp1 cKD小鼠表现出神经功能恶化。这与边缘区神经元中星形胶质细胞来源细胞内线粒体减少的结果一致。这一结果强调了星形胶质细胞在应激条件下保持大脑稳态的潜在作用。
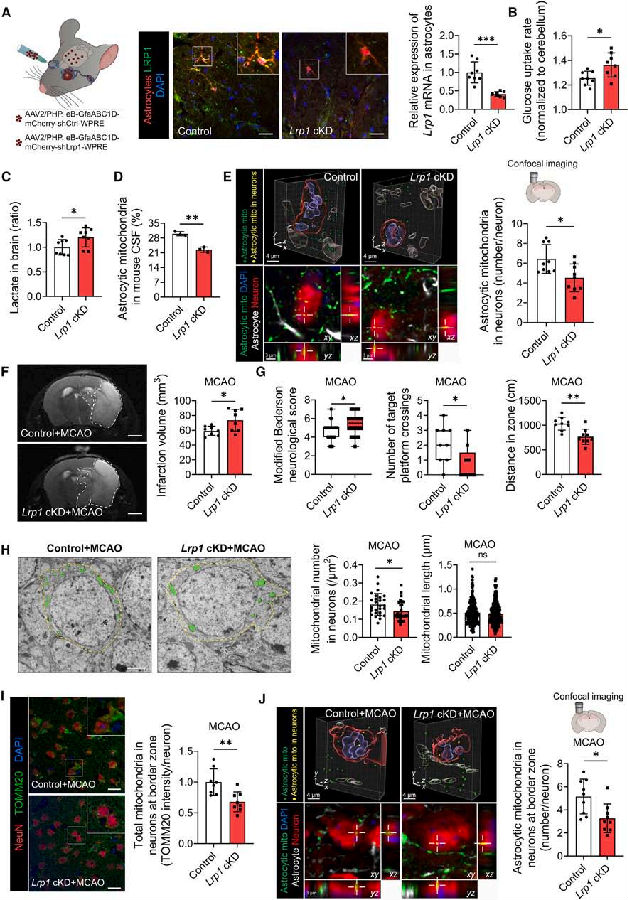
图4. LRP1调控的星形胶质细胞线粒体转移减轻脑缺血再灌注损伤
(图片来自《Cell Metabolism》)
研究者进一步测试了ARF1-K73乳酸化是否介导LRP1对脑I/R损伤的保护作用。将携带ARF1野生型(WT)、ARF1-K73R或ARF1-K73Q的2型腺相关病毒(AAV2)注射到星形胶质细胞特异性敲低Lrp1的C57BL/6J小鼠体内。与接受ARF1-WT的Lrp1 cKD小鼠相比,接受ARF1-K73R的小鼠在CSF和神经元中表现出更多的星形胶质细胞来源的线粒体。这表明在缺乏Lrp1的情况下,减少ARF1乳酸化会增加星形胶质细胞线粒体释放。用MCAO诱导这些小鼠I/R损伤,以评估ARF1-K73R和ARF1-K73Q在脑损伤中的作用。与ARF1-WT治疗的Lrp1 cKD小鼠相比,接受ARF1-K73R治疗的小鼠梗死面积减少,神经功能改善,边缘区神经元中星形胶质细胞来源的线粒体增加。这表明,星形胶质细胞ARF1乳酸化减少线粒体转移,加重脑I/R损伤。随后,研究者又量化了人类卒中患者和正常受试者的CSF乳酸水平。与正常对照相比,缺血性脑卒中患者CSF乳酸水平显著升高,乳酸水平与梗死面积呈正相关,与CSF星形胶质细胞线粒体呈负相关。这些结果支持了乳酸降低线粒体转移并加重脑I/R损伤的结论。
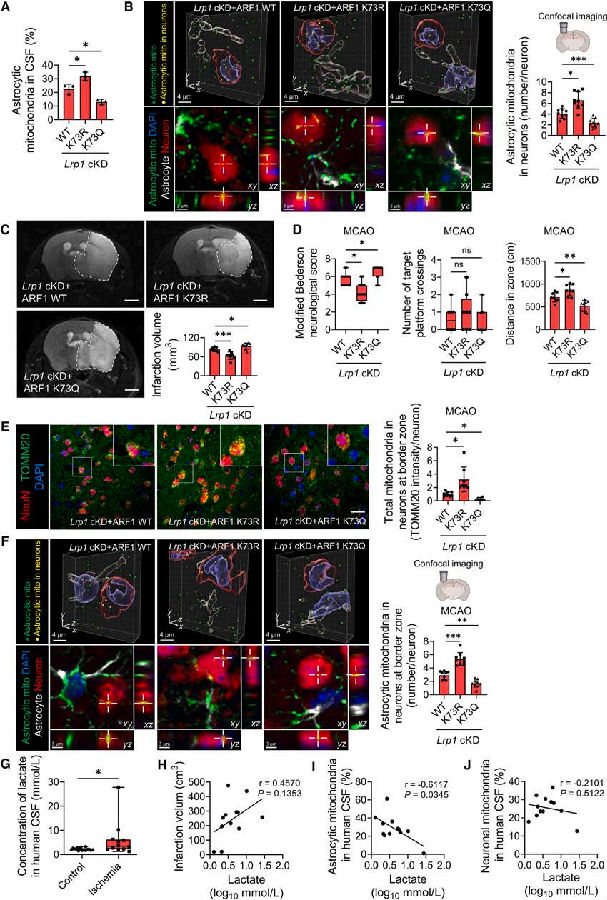
图5. 星形胶质细胞ARF1-K73乳酸化降低线粒体转移加重脑I/R损伤
(图片来自《Cell Metabolism》)
本研究揭示了LRP1通过调节健康线粒体从星形胶质细胞向受损神经元的转移发挥其在缺血性脑卒中中的保护作用。这为脑卒中和阿尔兹海默症等神经性相关疾病的研究提供了理论基础,也说明了靶向线粒体转移的干预手段在疾病预防和治疗中具有良好的应用潜力。
云克隆开发了上述研究中相关指标的蛋白、抗体和试剂盒产品,同时提供相关原代细胞和动物模型以助力科学研究,部分指标如下,供您参考:
相关蛋白、抗体和试剂盒:
指标名称 | 核心货号 | 指标名称 | 核心货号 |
LRP1 | B010 | GLUT1 | B185 |
AGL | D819 | VEGF | A143 |
MCT1 | H431 | A551 | FGF2 |
PANX1 | E788 | LDHA | D370 |
LDHB | B698 | ATP | A349 |
相关原代细胞和动物模型:
货号 | 细胞/模型名称 |
CSI011Mu01 | 小鼠脑星形胶质细胞(BA)原代细胞 |
CSI011Ra01 | 大鼠脑星形胶质细胞(BA)原代细胞 |
CSI011Rb01 | 兔脑星形胶质细胞(BA)原代细胞 |
CSI011Ca01 | 犬脑星形胶质细胞(BA)原代细胞 |
CSI099Mu01 | 小鼠脑干神经元细胞(BSNC)原代细胞 |
CSI099Ra01 | 大鼠脑干神经元细胞(BSNC)原代细胞 |
CSI099Rb01 | 兔脑干神经元细胞(BSNC)原代细胞 |
CSI100Mu01 | 小鼠中脑神经元细胞(MNC)原代细胞 |
CSI100Ra01 | 大鼠中脑神经元细胞(MNC)原代细胞 |
CSI100Rb01 | 兔中脑神经元细胞(MNC)原代细胞 |
CSI264Ca01 | 犬大脑皮层神经元细胞(CCNC)原代细胞 |
DSI523Mu01 | 脑缺血(CI)小鼠模型 |
DSI523Ra01 | 脑缺血(CI)大鼠模型 |
DSI523Rb01 | 脑缺血(CI)兔模型 |