I型干扰素驱动狼疮单核细胞中非经典IL-1β的分泌
系统性红斑狼疮(SLE)的临床表现从轻微的皮肤和/或关节症状到危及生命的病变不等。尽管许多SLE的表现可以归因于I型干扰素(IFN)的活性,但在临床试验中阻断这一途径只能提供部分缓解,这表明还有其他潜在的治疗靶点。2024年10月,《Immunity》杂志上发表了一篇题为“Type I IFN drives unconventional IL-1β secretion in lupus monocytes”的文章,在这项研究中,研究者发现系统性红斑狼疮单核细胞会同时产生IFN和白细胞介素-1b(IL-1b),细胞质对线粒体核酸的感知会诱导黏液病毒抗性蛋白(MxA)的产生,这使得IL-1b的分泌独立于消皮素D(GSDMD)和细胞焦亡。

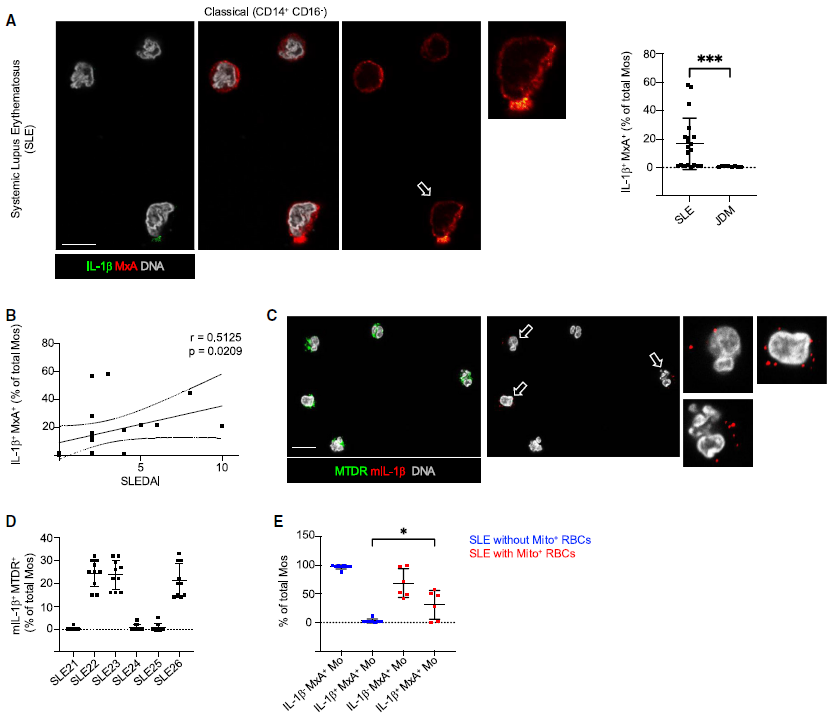
从SLE或幼年型皮肌炎(JDM)患者中分离出的巨噬细胞广泛表达MxA,高达60%的SLE巨噬细胞共表达IL-1b。免疫荧光(IF)结果显示,单个的SLE 巨噬细胞在存活状态下就能释放成熟IL-1b(mIL-1b),这表明体外培养的SLE巨噬细胞在未发生细胞死亡的情况下就准备好分泌mIL-1b。IL-1b+MxA+ Mos(血液单核细胞)主要存在于携带循环Mito+ RBCs(保留线粒体的红细胞)的患者中。这些Mos中有50%显示细胞质染色为红细胞标志物糖蛋白A(GPA),这提示红细胞被内化。通过流式细胞术测量了血液Mos内的细胞内GPA,在SLE患者的CD14+ Mos亚群中主要观察到GPA,该亚群也是表达IL-1b和MxA的主要群体。这些数据表明IL-1b+MxA+ Mos是系统性红斑狼疮的生物标志物。(见图1)

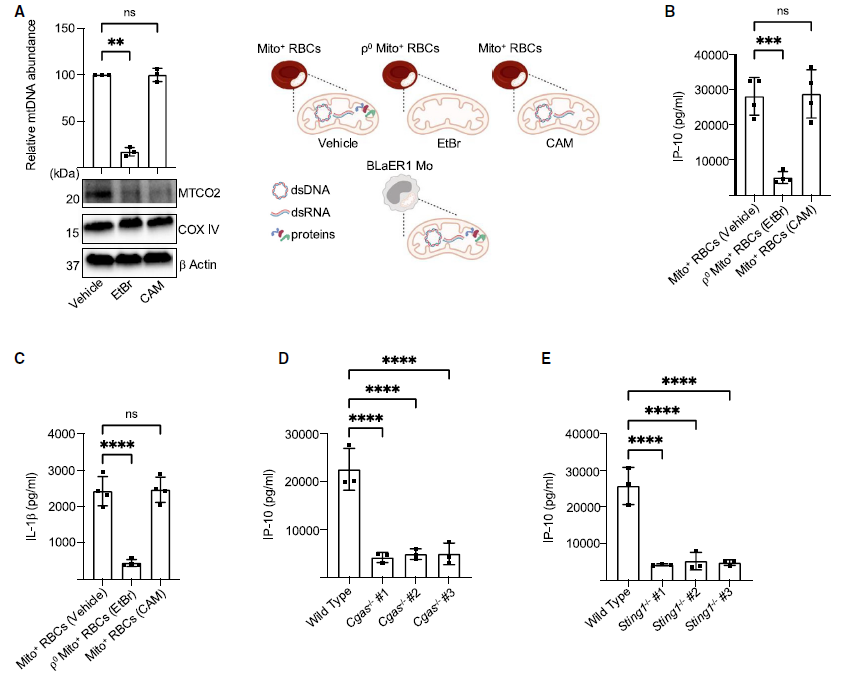
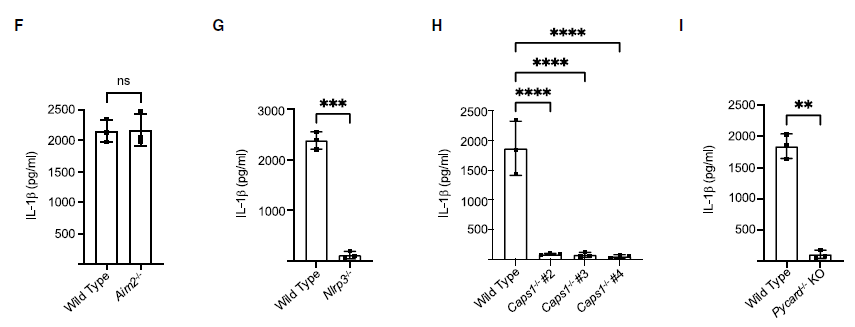
研究者发现Mito+ RBCs会诱导干扰素刺激基因(ISG)转录的上调。在Mito+ RBC处理过的Mos细胞的上清液中,IFN产生的标志物C-X-C基序趋化因子配体10(IP-10)和IL-1b浓度均显著增加。通过免疫印迹实验,全细胞裂解物(WCL)检测到MxA,同时在上清液中检测IL-1b。在骨髓(BM)Mos细胞,同时检测到IP-10和IL-1b。为了揭示这种双重细胞因子产生的机制,研究者使用BLaER1 Mos并且生成了缺乏线粒体核酸(mtNAs)的红细胞(ρ0 Mito+ RBCs),ρ0 Mito+ RBCs处理的BLaER1 Mos,IP-10和IL-1b表达量显著减少,表明Mito+ RBC衍生的mtNAs是这种反应的主要驱动因素。研究人员发现在响应Mito+ RBCs时,Gas-/-或Sting1-/- BLaER1 Mos中IP-10的表达量相对于对照组降低。另外,细胞质mtDNA也能激活NLRP3炎性小体,实验结果表明Nlrp3-/-、Casp1-/-和Pycard-/-或者对该通路的药理阻断,也能显著减少IL-1b的产生。(见图2)
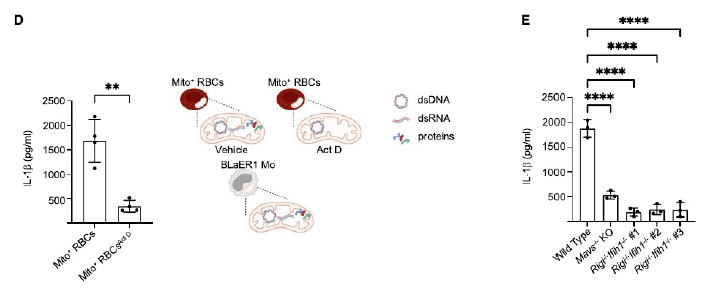
为了激活cGAS和 NLRP3,Mito+ RBC衍生的mtDNA必须离开吞噬溶酶体并到达胞质。研究者将Mito+ RBCsEdU和BLaER1 Mos共培养,IF分析显示存在溶酶体相关膜蛋白1(LAMP1)EdU+斑点,说明Mito+ RBC衍生的mtDNA LAMP1+逃逸且吞噬溶酶体并到达细胞质。Mito+ RBCsBrdU和BLaER1 Mos共培养,免疫沉淀发现在cGAS免疫复合物(ICs)中检测到BrdU信号,NLRP3 ICs中未检测到BrdU信号,这表明Mito+ RBC衍生的mtDNA不太可能是激活NLRP3 的配体。(见图3)


之后,研究人员对NLRP3免疫复合物相关的DNA进行RT-qPCR分析,结果显示线粒体扩增子富集,且仅在D环区域扩增子中富集,这表明D环区可以调节mtDNA对cGAS或NLRP3的亲和力。Mito+ RBCs与BLaER1 MosEdU共培养,IF分析显示细胞质中存在mtDNA的积累。在mtRNA聚合酶抑制剂放线菌素D26的情况下Mito+ RBCs无法促进IL-1b的产生,这表明是Mito+ RBCs的mtRNA驱动了这种反应。在缺乏RLRs(Rigi-/-和Ifih1-/-)的BLaER1 Mos 细胞中,与NLRP3 结合的mtDNA水平、Casp1的激活以及IL-1b的分泌均减少,这支持了它们协同感知细胞质mtRNA的观点。(见图4)

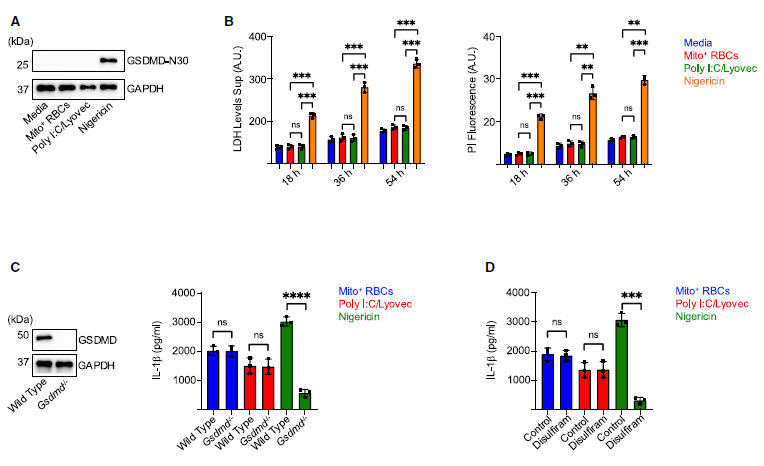
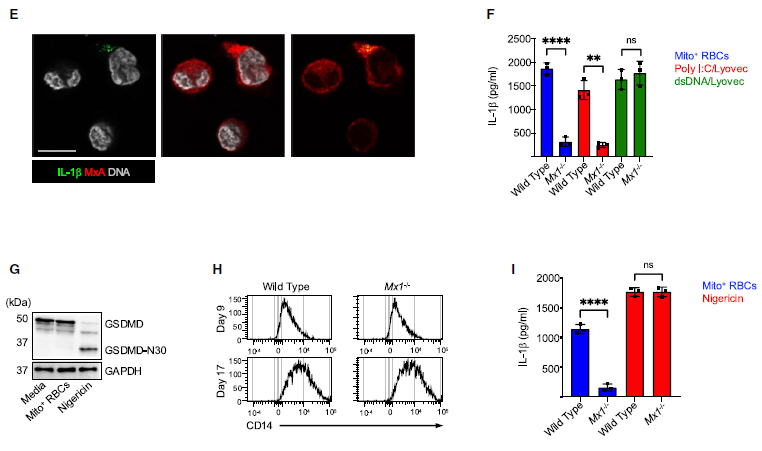
研究者用Mito+ RBC 或聚肌胞诱导的BLaER1 Mos并未显示出孔隙形成的迹象。在这些条件下形成的GSDMD-N30可能低于抗体的检测阈值,和/或可能不足以引起可观察到的碘化丙啶(PI)内流,但仍能导致膜孔隙的形成。然而,在Gsdmd-/- BLaER1 Mos或经GSDMD抑制剂二硫仑处理的原代Mos中,mIL-1b 的分泌未受到影响。这些发现说明mIL-1b在Mos细胞中对Mito+ RBCs和poly I:C的反应独立于GSDMD。正如预期的那样,Mito+ RBC刺激的iPSC Mos以NLRP3/Casp1依赖的方式释放mIL-1b,MxA缺陷既不影响iPSC Mos的分化,也不改变NLRP3的表达。然而,用Mito+ RBCs激活Mxa-/- iPSC Mos会导致mIL-1b释放受损,进一步支持MxA参与人类原代Mos中非传统的mIL-1b分泌。(见图5)
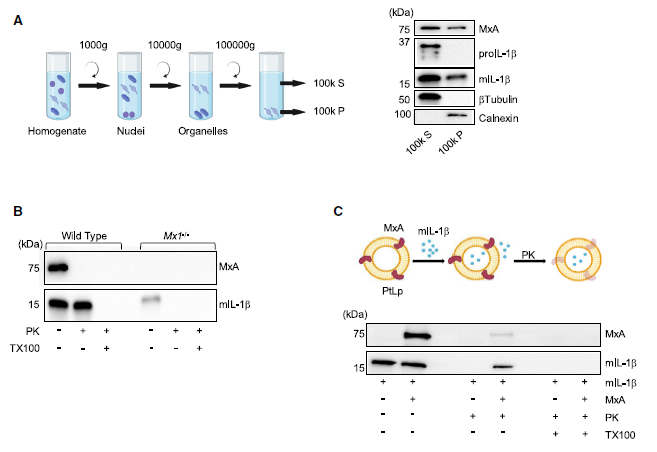
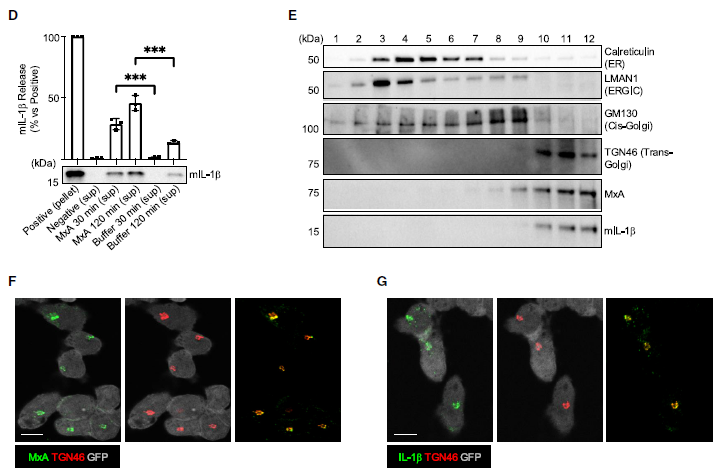
蛋白酶K(PK)保护实验表明,MxA位于表面,而mIL-1b位于亚细胞膜的腔内。MxA缺陷减少了膜相关的mIL-1b,并且在Mxa-/- BLaER1 Mos膜中检测到的残留mIL-1b不能免受PK消化的影响。通过基于蛋白脂质体(PtLp)的运输实验,PtLp膜中MxA的存在保护了约50%的mIL-1b免受蛋白酶消化影响。研究者检测了MxA和mIL-1b的分布情况,发现MxA和 mIL-1b与高尔基体网络(TGN)一致。免疫荧光(IF)分析显示,MxA和mIL-1b共定位在这个亚细胞区室中。这些发现支持了MxA在促进mIL-1b向高尔基体转位以积极推动其非常规分泌方面的作用。(见图6)
总的来说,这些研究表明,在SLE 患者的血液中,存在携带红细胞、表达诱导ISGs并准备释放mIL-1b 的Mos,mIL-1b 的分泌是通过一种不依赖于GSDMD 和细胞焦亡的方式进行的,而是依赖于IFN 诱导蛋白MxA,这为治疗系统性红斑狼疮提供一种新的潜在靶点。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 核心货号 |
IL-1β | A563 | ISG15 | L630 |
CD19 | B873 | B actin | B340 |
LMAN1 | C567 | AIM2 | G302 |
cGAS | U056 | Calnexin | A280 |
NLRP3 | K115 | STING | N011 |
CD11b | B685 | GAPDH | B932 |
CD14 | A685 | CD71 | B171 |