自噬在心脏中的作用:从稳态到治疗
自噬是几乎所有真核细胞(包括心血管系统细胞)质量控制所需的稳态和存活机制。特别的是,长寿的心肌细胞在很大程度上依赖于自噬的管家功能,因为它们是终末分化的细胞。因此,心脏以及整个循环系统特别容易受到自噬扰动的影响。自噬与自发发展特定心血管疾病的倾向增加有关,包括多种形式的心肌病。在多种心血管疾病动物模型中,自噬的药理学或遗传抑制通常会加速疾病进展并恶化疾病结果。此外,自噬的重要作用在心脏衰老的背景下尤为突出,在这种情况下,对受损蛋白质和细胞器的降解需求越来越大。根据这一概念,通过热量限制或给予mTOR靶点抑制剂雷帕霉素来增加自噬的策略可以预防衰老性心肌病的发展。因此,靶向自噬信号通路可能在治疗心血管疾病中提供治疗益处。
1. 硫氧还蛋白1通过心肌缺血时Atg7的转亚硝化促进自噬
氧化和亚硝化应激对半胱氨酸残基的修饰会影响蛋白质的结构和功能,从而导致心血管疾病的发病机制。尽管硫氧还蛋白1(Trx1)的主要功能是减少二硫键,但它也可以以依赖于上下文的方式作为脱硝糖基酶或反亚硝酰酶。美国罗格斯新泽西医学院心血管研究所Junichi Sadoshima团队发现Trx1反亚硝酰化Atg7,一种E1样酶,从而刺激自噬[1]。在缺血期间,Trx1在氧化还原酶催化中心的Cys32-Cys35处被氧化,在Cys73处被S-亚硝基化。出乎意料的是,Atg7 Cys545-Cys548通过巯基-二硫化物交换减少了Trx1中Cys32-Cys35处的二硫键,这使得NO从Trx1中的Cys73释放出来,并转移到Cys402处的Atg7。用Atg7 C402S敲除小鼠进行的实验表明,Atg7在Cys402处的S-亚硝基化通过刺激E1样活性促进自噬,从而保护心脏免受缺血(图1)。这些结果表明,巯基二硫化物交换和NO转移在功能上是耦合的,允许氧化Trx1在心肌缺血期间通过Atg7的转亚硝基化和自噬刺激介导有益的作用。
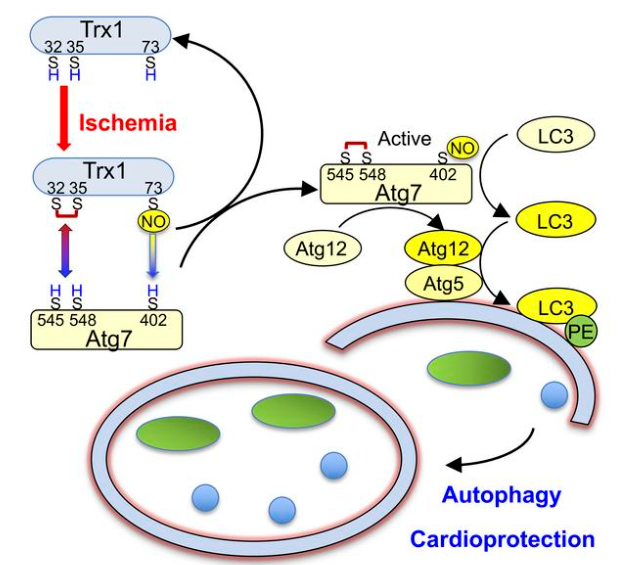
图1 Trx1通过心肌缺血时Atg7的转亚硝化促进自噬
2. DRP1在肥胖心肌病常规和替代性自噬中的不同作用
尽管已有研究表明动力蛋白相关蛋白1(DRP1)介导的线粒体分裂和随后线粒体受损部分的分离对于线粒体自噬是必不可少的,但DRP1在线粒体自噬中的参与仍然存在争议。罗格斯新泽西医学院细胞生物学和分子医学系Junichi Sadoshima团队研究了内源性DRP1在介导高脂饮食(HFD)诱导的肥胖心肌病期间的自噬中的重要作用[2]。HFD摄入3周后,线粒体吞噬增加。在心脏特异性DRP1敲除(Drp1 MCM)小鼠心脏中,HFD消耗对线粒体吞噬的诱导完全被消除,其中舒张和收缩功能障碍都加剧了。在Drp1 MCM小鼠中,微管相关蛋白1轻链3(LC3)依赖性的一般自噬和LC3与线粒体蛋白之间的共定位的增加被消除。在HFD消耗的慢性阶段,Drp1 MCM小鼠的选择性自噬激活也被完全消除。机制分析表明,DRP1在Ser616处磷酸化,定位于线粒体相关膜,仅在HFD消耗的慢性而非急性阶段与Rab9和Fis1相关(图2)。这些结果表明DRP1是控制多种形式线粒体吞噬的肥胖心肌病线粒体质量控制的重要因素。
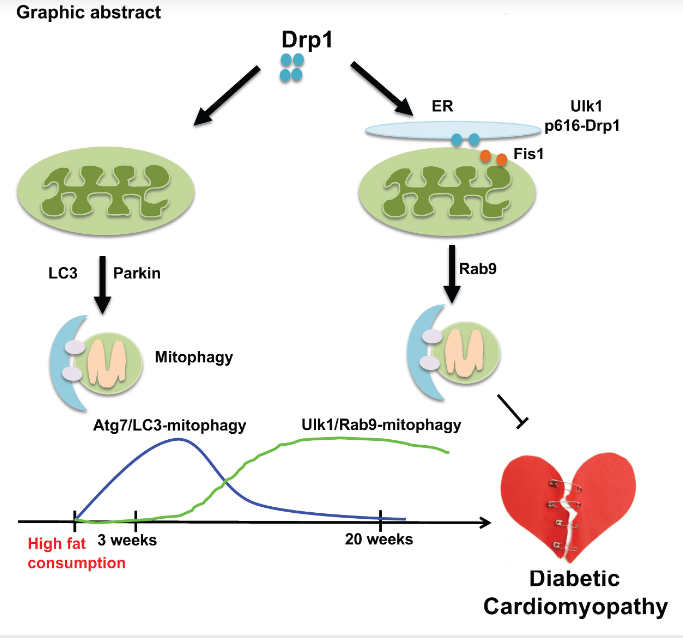
图2 DRP1在肥胖心肌病常规和替代性自噬中的不同作用
3. 新型纳米颗粒通过自噬和mTOR途径激活心外膜上皮-间质转化,促进心脏修复
用治疗性外源细胞恢复受损的心肌组织仍然存在一些局限性,如免疫排斥、心脏特性不成熟、致瘤风险以及缺血心肌微环境中的细胞存活率低。用功能性生物材料激活内源性干细胞可能会克服这些局限性。南方医科大学附属第五医院Xiaozhong Qiu团队本研究探讨了功能性携带过硫酸铵(APS)的纳米颗粒(NPs/APS)在肾母细胞瘤1阳性(WT1+)心外膜细胞上皮间充质转化(EMT)和心肌梗死(MI)修复中的作用[3]。WT1+心外膜细胞在体外用NPs/APS处理后转化为内皮样细胞,在体内将NPs/APS注射到梗死心脏后,心脏功能显著改善(图3)。此外,在NPs/APS诱导的WT1+心外膜细胞EMT过程中,证实了自噬和mTOR通路的同时激活。这项研究共同强调了NPs/APS在心肌梗死修复中的作用。
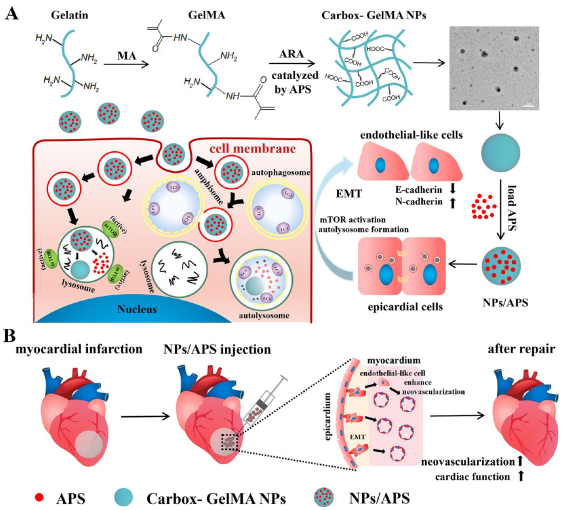
图3 NPs/APS体外诱导WT1+心外膜细胞EMT以及体内心脏修复
云克隆不仅可提供多种心血管系统疾病模型,包括动脉粥样硬化、心肌肥厚、心肌梗死、心律失常、心力衰竭等,涵盖常见心血管系统疾病。还具有多个物种心脏微血管内皮细胞、心肌细胞、心肌成纤维细胞、心包膜成纤维细胞等原代细胞产品和各类心血管系统与自噬信号通路常用指标及上述mTOR、Trx1、Atg7、DRP1、Fis1等相关产品,可助力广大科研工作者进行自噬与心血管系统疾病研究。
相关动物模型
心肌肥厚(CH)小鼠模型• DSI548Mu03
建模方法
1. 小鼠选择:SPF 级生产的小鼠,选择 6-8 周龄健康雄性小鼠为实验对象。
2. 称重麻醉备皮:准确称取小鼠体重(g),行腹腔注射麻醉小鼠,待小鼠充分麻醉倒(约 3-5min)后,用小鼠剃毛器剃除小鼠颈部及胸前毛发(充分暴露手术区)。
3. 倒置小鼠使小鼠头部在手术人员一侧 抬升头部在 30°,颈部中间竖直开口至胸上肋骨起始处,沿肋骨起始处肋中线向下剪开 0.5mm 扩大视野,从颈部气管钝性分离至看见胸腺。轻轻拨开胸腺游离脂肪便可清晰观察到主动脉弓,从主动脉弓底引 7-0 不可吸收缝合线,连同自制缩窄工具(27G)勒紧打死结,抽出缩窄工具。完成 TAC 手术,整个实验过程保持小鼠体温 37℃左右。
4. 缝合:结扎完成后,6-0 缝线完全缝合胸腔前端开口(保证无缝隙、无错位),最后用 5-0 缝线将皮肤切口缝合完整。
5. 术后管理:术后密切关注小鼠状态。待小鼠自然苏醒后,放入干净的饲养笼,填写手术记录卡片,放回饲养室,密切关注小鼠术后状态以及死亡情况并做好相应记录。

心肌梗死(MI)大鼠模型• DSI504Ra02
建模方法:
1. 麻醉大鼠,用小动物剃毛器剃除大鼠胸部及腋下毛发(充分暴露手术区),用碘酒和 75%乙醇术区消毒。
2. 气管插管:麻醉后,夹趾检测无反应即可进行 MI 手术。打开外置光源、显微镜开关,打开呼吸机,设置好各参数(呼吸比 2:1,潮气量 6-8 mL,频率 70 次 /min),将气管插管沿声门插入气管,取下大鼠接上呼吸机,观察大鼠呼吸状况,胸廓起伏与呼吸机频率一致表示插管成功,即可进行 MI 手术。
3. 大鼠采用右侧卧位,用眼科剪在左前肢腋下,用显微剪于三、四肋间打开胸腔充分暴露心脏,显微直镊轻轻夹起少量心包并于左心耳下撕开少许心包,充分暴露左冠状动脉前降支(LAD)或所在区域。
4. 结扎冠状动脉:于显微镜下找到 LAD 走向或可能所在位置 , 持针器持取 5-0 带针缝合线,于左心耳根部下方肺动脉圆锥旁以 5-0 无创缝合线穿过左冠状动脉前降支 ( LAD),以完全阻断 LAD 血流。
5. 关胸:结扎完成后,5-0 缝线完全缝合胸腔开口(保证无缝隙、无错位)关闭胸腔,由内向外逐层缝合各层肌肉和皮肤。
6. 术后管理:术后密切关注大鼠状态,有无呼吸异常等。待大鼠自然苏醒后将大鼠从呼吸机上取下并取下气管插管,正常饲养。
参考文献
[1]Nagarajan N, Oka SI, Nah J, et al. Thioredoxin 1 promotes autophagy through transnitrosylation of Atg7 during myocardial ischemia. J Clin Invest. 2023;133(3):e162326. (IF=13.3)
[2]Tong M, Mukai R, Mareedu S, et al. Distinct Roles of DRP1 in Conventional and Alternative Mitophagy in Obesity Cardiomyopathy. Circ Res. 2023;133(1):6-21. (IF=16.9)
[3]Song C, Kong F, Nong H, et al. Ammonium Persulfate-Loaded Carboxylic Gelatin-Methacrylate Nanoparticles Promote Cardiac Repair by Activating Epicardial Epithelial-Mesenchymal Transition via Autophagy and the mTOR Pathway. ACS Nano. 2023;17(20):20246-20261. (IF=15.8)