自噬疗法:神经退行性疾病的未来之路
自噬是细胞通过溶酶体降解蛋白质或细胞器的过程。当细胞生长或受到外部刺激时,细胞内蛋白质或细胞器需要通过自噬或蛋白酶系统清除或更新。一些小分子物质或短寿命蛋白质主要通过泛素-蛋白酶体途径降解,而细胞质中的长寿命蛋白质或受损细胞器则通过自噬-溶酶体途径降解。越来越多的研究发现,自噬在神经细胞的发育和突触的功能中起着重要作用。自噬水平异常会导致神经系统损伤,包括自噬体聚集、神经元萎缩、线粒体耗竭以及轴突和树突萎缩。异常蛋白质在患者的大脑中积聚,导致神经元的慢性进行性变性和丧失,可导致帕金森病(PD)、阿尔茨海默病(AD)、亨廷顿氏病(HD)、肌萎缩侧索硬化症和路易体痴呆症等神经退行性疾病。因此,神经退行性疾病与自噬功能异常密切相关,靶向自噬可能是神经退行性疾病治疗的潜在策略。
1. 自噬适配器TRIAD3A通过相分离促进tau蛋白纤维化
多种神经退行性疾病的特征是tau蛋白的异常积聚。美国约翰霍普金斯大学医学院神经科学系Wenchi Zhang团队报道了一种RING-type E3连接酶,TRIAD3A,它的功能是作为tau的自噬适配器[1]。研究表明,TRIAD3A E3连接酶催化混合的K11/K63多泛素链并自组装成液-液相分离(LLPS)液滴。Tau泛素化并在TRIAD3A LLPS液滴中积累,并通过LC3相互作用区域靶向Tau进行自噬降解(图1)。在没有tau过渡液相的情况下,被隔离在TRIAD3A液滴中的tau迅速转化为纤维聚集体。体内研究表明,TRIAD3A在tau蛋白病小鼠模型中减少了磷酸化tau蛋白的积累,并且TRIAD3A的疾病相关突变增加磷酸化tau的积累,加剧胶质增生并增加病理性tau扩散。在人类AD大脑中,TRIAD3A以多种组织学形式与tau淀粉样蛋白共定位,提示其在tau蛋白稳态中起作用。这些结果表明TRIAD3A是一种自噬接头,利用E3连接酶和LLPS作为捕获货物的机制,似乎与神经退行性疾病特别相关。

图1 自噬接头TRIAD3A介导的降解途径示意图
2. 黑磷纳米片通过降解聚集性α-syn和清除PD中的ROS来保护神经元
尽管有证据表明,黑质多巴胺神经元中α-synuclein(α-syn)的异常积累是PD的主要病理特征,但没有一种同时具有α-syn抗聚集和α-syn降解功能的化合物在临床上成功治疗该病。贵州医科大学基础医学院分子医学工程研究中心Chunlin Zhang团队表明,黑磷纳米片(BPNS)直接与α-syn原纤维相互作用,引发其分解以治疗PD[2]。此外,BPNS通过范德华力对α-syn具有特异性亲和力。BPNS被发现可以激活自噬以维持α-syn稳态,改善线粒体功能障碍,降低活性氧水平,并挽救PC12细胞中的神经元死亡和突触损失。还观察到BPNS穿透血脑屏障,防止多巴胺神经元损失,缓解1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠模型和hA53Tα-syn转基因小鼠的行为障碍(图2)。总之,这项研究表明,BPNS有潜力成为一种新型的综合纳米药物,用于神经系统疾病的临床诊断和治疗。
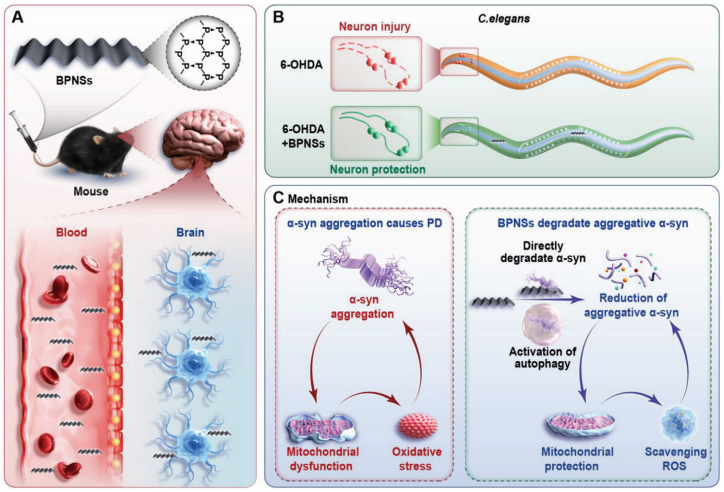
图2 BPNS对秀丽隐杆线虫和小鼠PD模型的神经保护作用的示意图
3. 自噬优先降解非原纤维polyQ聚集体
含有扩增聚谷氨酰胺(polyQ)重复序列的蛋白质聚集是一组显性遗传性神经退行性疾病的细胞病理学标志,包括HD。亨廷顿蛋白(Htt)是HD的疾病蛋白,通过液固相转变形成淀粉样纤维。自噬已被提出用于清除polyQ聚集物,但效率有限。德国马克斯普朗克生物化学、分子机器与信号研究所Florian Wilfling团队使用低温电子断层扫描来观察原位培养细胞中自噬体与polyQ聚集体的相互作用[3]。他们发现,在径向组织的polyQ原纤维旁边存在无定形聚集相。自噬体优先吞噬这种无定形物质,这是由自噬受体p62/SQSTM1和非纤维聚集体表面之间的相互作用介导的(图3)。相比之下,淀粉样纤维排斥p62并逃避清除,导致自噬结构被捕获。这些结果表明,自噬清除polyQ聚集体的效率有限是由于自噬体无法与不可变形的纤维状疾病聚集体有效相互作用。

图3 自噬优先降解非原纤维polyQ聚集体
云克隆不仅可提供多种神经系统疾病动物模型,包括帕金森、阿尔兹海默症、焦虑症、慢性应激抑郁等,涵盖常见神经系统疾病。还具有各类神经系统疾病和自噬检测指标及上述a-Syn、SQSTM1等相关产品,可助力广大科研工作者进行自噬与神经系统疾病相关研究。
相关动物模型
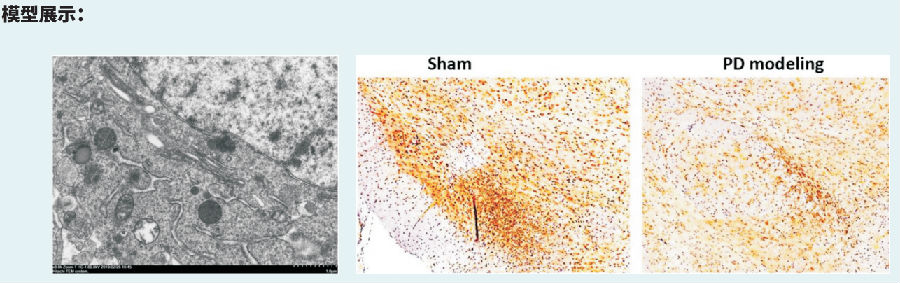
帕金森病(PD)小鼠模型
建模方法:
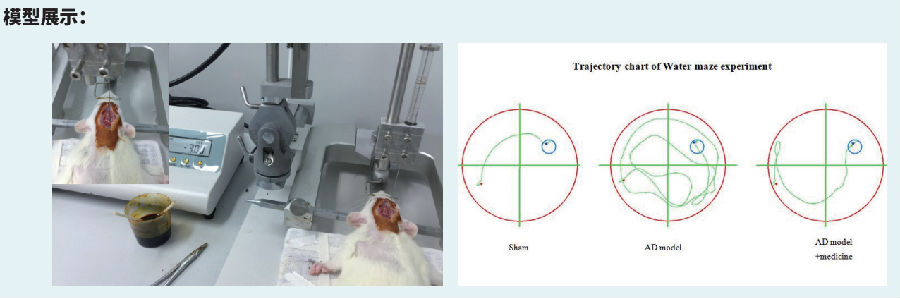
阿尔茨海默病(AD)大鼠模型
建模方法:
麻醉大鼠,麻醉后继而固定于脑立体定位仪上。按照大鼠脑立体定位图谱,以前囟为零起点,前囟后3.5mm处为穿刺点,中线右侧旁开2mm,而后牙科钻钻开颅骨,采用微量注射器自脑表面垂直进针3mm,即:(AP=-3.5mm, ML=2.0mm, DV=3.0mm),双侧海马CA1区缓慢匀速注射Aβ1-40各10μg(1μL),留针5min,退针后缝合伤口。造模后3d后,开始尾静脉注射,注射生理盐水,大鼠每只给药100μl/次/d,连续给药21d后,进行水迷宫行为学检测。
参考文献
[1]Zhou J, Chuang Y', Redding-Ochoa J, et al. The autophagy adaptor TRIAD3A promotes tau fibrillation by nested phase separation. Nat Cell Biol. 2024;26(8):1274-1286. (IF=17.3)
[2]He M, Zhang X, Ran X, et al. Black Phosphorus Nanosheets Protect Neurons by Degrading Aggregative α-syn and Clearing ROS in Parkinson's Disease. Adv Mater. 2024;36(30):e2404576. (IF=27.4)
[3]Zhao DY, Bäuerlein FJB, Saha I, Hartl FU, Baumeister W, Wilfling F. Autophagy preferentially degrades non-fibrillar polyQ aggregates. Mol Cell. 2024;84(10):1980-1994.e8. (IF=14.5)