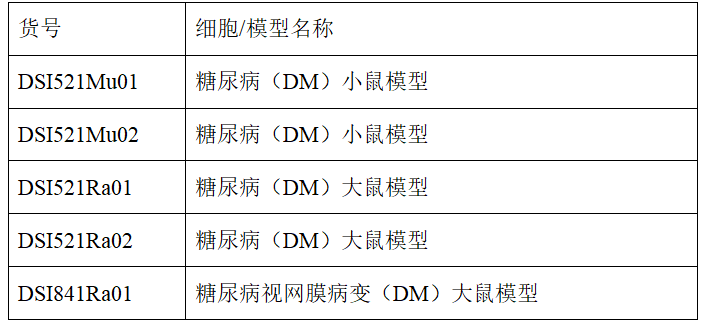
高血糖引发的脂质过氧化会破坏2型糖尿病中STAT4稳定性并损害机体抗病毒Th1反应
2型糖尿病(T2D)的主要特征是高血糖,它会逐渐对多个器官造成损害,从而引发一系列并发症。T2D患者更容易发生严重的呼吸道病毒感染,但其潜在机制尚不清楚。最近,《Cell Metabolism》上发表了题为“Hyperglycemia-triggered lipid peroxidation destabilizes STAT4 and impairs anti-viral Th1 responses in type 2 diabetes”的文章,发现T2D患者以及T2D小鼠表现出Th1辅助细胞(Th1)缺陷反应,这种缺陷源于由高血糖引起的CD4+ T细胞内在代谢紊乱。这些异常促进脂质过氧化(LPO),从而驱动信号传导及转录激活蛋白(STAT4)的羰基化,这是一个关键的Th1分化决定因子。羰基化的STAT4快速降解,导致T-bet诱导减少,Th1分化减弱。这一发现对控制T2D相关病毒并发症具有重要意义。
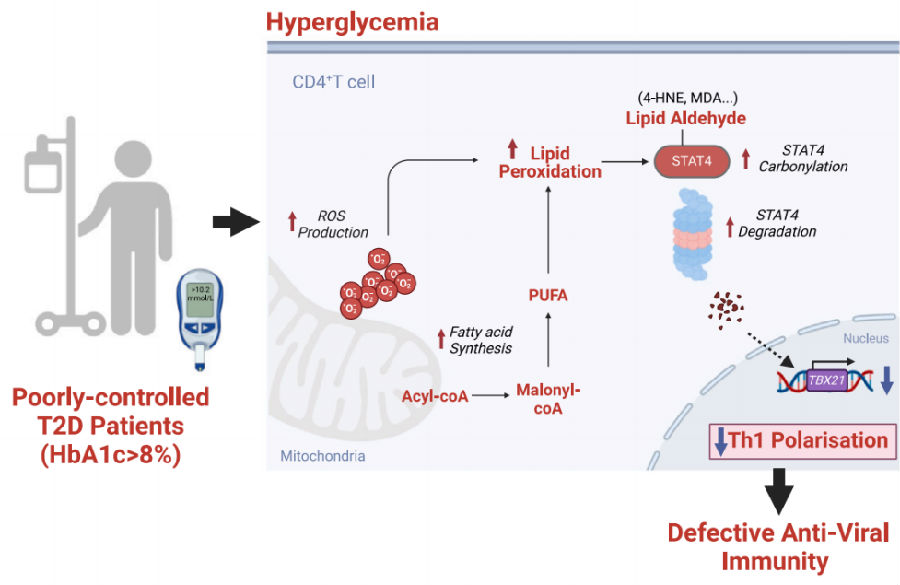
图1. 高血糖-LPO-STAT4轴导致T2D宿主中抗病毒Th1活性降低
(图片来自《Cell Metabolism》)
为了研究T2D患者在呼吸道病毒感染后的T细胞反应,研究者分析了来自重症COVID-19患者支气管肺泡灌洗液(BALs)的T细胞单细胞RNA测序(scRNA-seq)数据。与抗病毒为中心的反应⼀致,Th1细胞构成了COVID-19患者BAL中主要的细胞群体。T2D并未阻碍Th1细胞的早期激活。然而,T2D患者的Th1细胞⽐例显著低于⽆T2D患者,导致T2D患者BAL中的Th1特征减少。值得注意的是,T2D对BAL Th1细胞的增殖和⽣存率没有影响,这表明观察到的Th1细胞⽐例较低可能是由于Th1分化受损所致。通过A型流感病毒(IVA)感染小鼠模型来验证这一推测。通过给雄性C57BL/6小鼠喂食脂肪饮⻝(HFD)来诱导T2D。随后,这些小鼠通过鼻腔接种了流感PR8株。与临床观察结果⼀致,T2D患者患重症流感的风险更高,PR8感染的⾼脂饮食小鼠⽐标准饮食小鼠体重损失更⼤,病毒清除能⼒更差。感染后第8天的肺浸润物分析显示,高脂饮食小鼠中NP311‒325特异性CD4+ T细胞的数量显著低于标准饮食小鼠。值得注意的是,高脂饮食小鼠的这些抗原特异性CD4+ T细胞向Th1谱系极化减少,细胞毒性活性降低,表现为STAT4和T-bet的表达降低,以及IFN-γ和颗粒酶B的产⽣减少。总的来说,这些数据表明,T2D会导致呼吸道病毒感染后Th1反应受损。

图2. T2D患者和小鼠在病毒感染期间表现出Th1反应受损
(图片来自《Cell Metabolism》)
接着,作者推测在急性感染期间Th1极化的显著下降是否会导致T2D患者记忆CD4+ T细胞室中Th1细胞的减少。为此,研究者从T2D患者和健康对照组中分别收集外周血单个核细胞(PBMC)样本进行研究。观察到与健康人和患有单纯性肥胖症(WC-T2D)的患者相比,在患有妊娠期糖尿病(PC-T2D)的患者中检测到Th1记忆细胞显著减少。这支持了T2D患者Th1反应受损的观点,并表明这种损伤与高血糖有关。接下来,他们试图确定PC-T2D患者Th1反应减弱是否源于其T细胞的内在缺陷。在Th1极化条件下培养从健康人、WC-T2D患者或PC-T2D患者中分离出的原始T细胞,并通过检测包括STAT4、T-bet和IFN-γ在内的Th标志物的表达水平来评估这些细胞的质量。培养6天后,从所有三组中收集到相似数量的活细胞。但患有PC-T2D患者的Th1细胞中STAT4和T-bet的表达显著降低,IFN-γ产生者的比例也有所下降。因此,高血糖,而非胰岛素敏感性,导致了T2D患者Th1细胞的损伤。接下来,他们在不同葡萄糖浓度的培养基中对源自肝细胞的Th1细胞进行极化。发现,在高糖条件下极化的细胞与生理葡萄糖水平(5.5mM)下的细胞相比,Th1特征明显减少。总之,这些数据表明,在高血糖型T2D宿主中,单独的高血糖就足以导致Th1功能障碍。
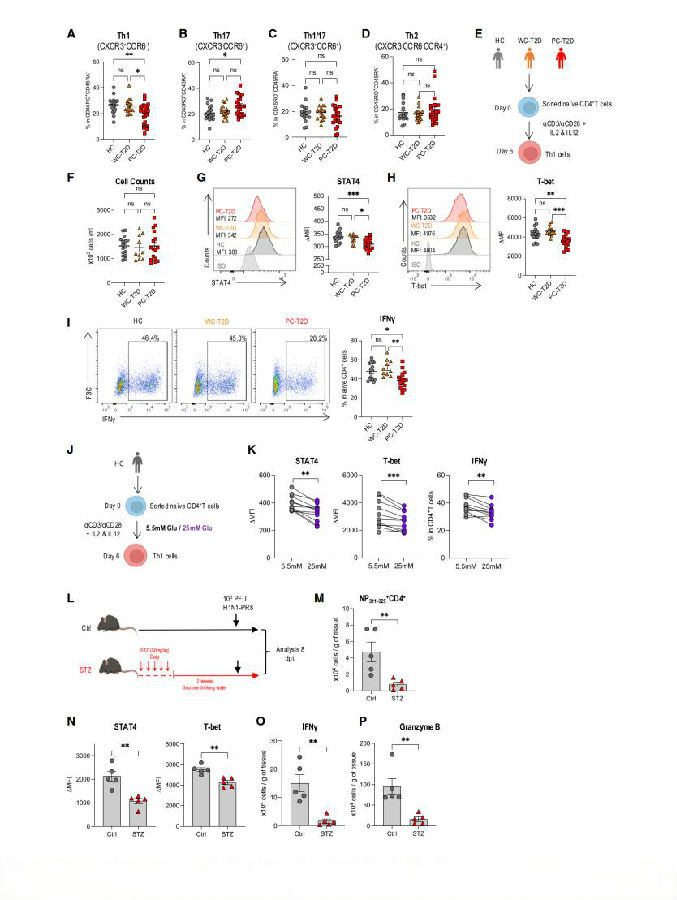
图3. CD4 + PC-T2D患者的T细胞向Th1细胞分化的能⼒较弱
(图片来自《Cell Metabolism》)
LPO是一种有害的代谢事件,与T2D患者的CD8+T细胞功能障碍有关。然而,其对Th1反应的影响仍不清楚。值得注意的是,与健康对照者(HCs)和WC-T2D的患者相比,PC-T2D患者的Th1细胞中LPO显著增加。此外,在新冠肺炎T2D患者的Th1细胞中,LPO相关基因表达上调。这些发现表明,在PC-T2D患者中观察到的LPO升高与Th1细胞分化缺陷之间存在潜在联系。为了进一步验证这一点,作者将从HCs中分化的未激活的T细胞(CD4+ T细胞)在添加和不添加促红细胞生成素(erastin)的情况下分化为Th1细胞。促红细胞生成素不影响体外分化的Th1细胞的扩增或存活。然而,促红细胞生成素处理导致STAT4和T-bet表达降低,同时IFN-γ生成减少。重要的是,PC-T2D患者中Th1细胞分化的受损是由LPO介导的。LPO抑制剂脂蛋白-1显著增加了PC-T2D患者来源的Th1细胞中STAT4和T-bet的表达水平,并恢复了IFN-γ的产生。
研究者进一步在基因水平证实了这些发现。酰基辅酶A(CoA)合成酶长链家族成员4(ACSL4)和谷胱甘肽过氧化物酶4(GPX4)分别是LPO的正调节剂和负调节剂。在源自肝细胞(HCs)的活化的CD4+ T细胞中,通过敲低ACSL4(ACSL4 KD)以及过表达GPX4(GPX4 OE)来抑制LPO。发现,尽管在生理葡萄糖水平(5.5mM)下,ACSL4 KD和GPX4 OE对Th1分化没有影响,但这些基因干预有效地降低了LPO水平,并增强了在高糖条件(25mM)下极化的CD4+ T细胞的Th1特征。这些发现表明,T2D宿主的高血糖会加剧CD4+ T细胞LPO,从而阻碍它们分化为Th1细胞的能力。纠正这一缺陷可能是改善这些个体病毒控制情况的关键。
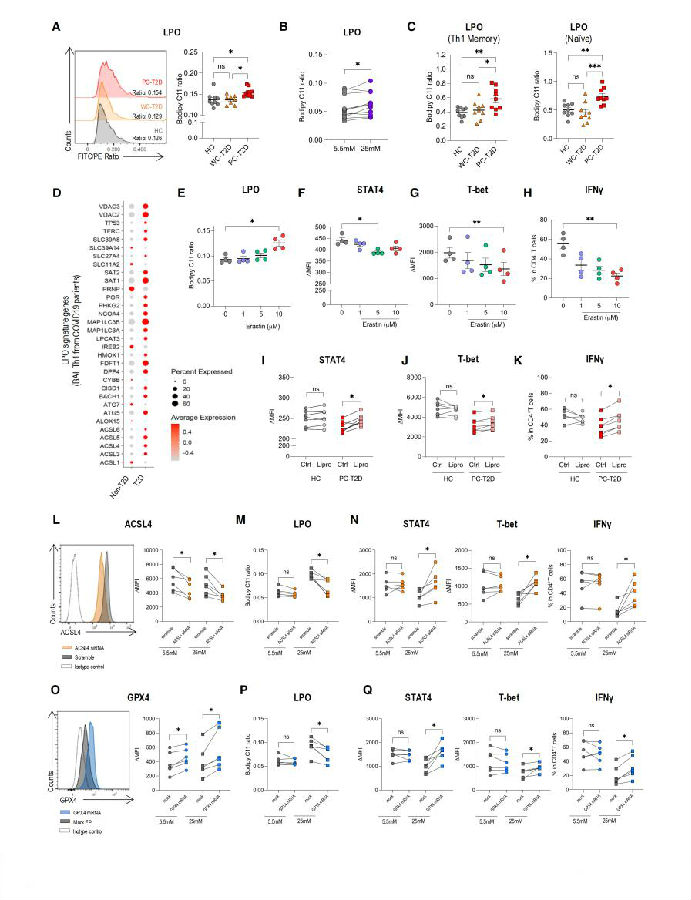
图4. LPO升高会阻碍PC-T2D患者的Th1分化
(图片来自《Cell Metabolism》)
接下来,作者试图确定LPO抑制Th1分化的机制。CarSPred软件进行分析显示,STAT4蛋白中有几个预测的羰基化位点,但T-bet中没有,这表明STAT4蛋白是LPO在破坏Th1分化过程中的主要靶点。由于TBX21的表达在Th1细胞中受到STAT4的增强,作者假设LPO诱导的羰基化降低了STAT4蛋白的稳定性,导致TBX21诱导减少,Th1分化受损。为了验证这一假设,研究者首先测量了羰基化蛋白的丰度,发现与这些细胞中检测到的LPO水平差异一致。此外,通过erastin诱导LPO增强了体外分化的Th1细胞中羰基化蛋白的细胞内水平。免疫印迹分析显示,在erastin处理后,STAT4的羰基化增加,而T-bet的羰基化没有增加。总之,这些数据表明LPO触发STAT4的羰基化。这些数据支持了LPO通过羰基化介导的STAT4降解来阻碍Th1分化的观点。
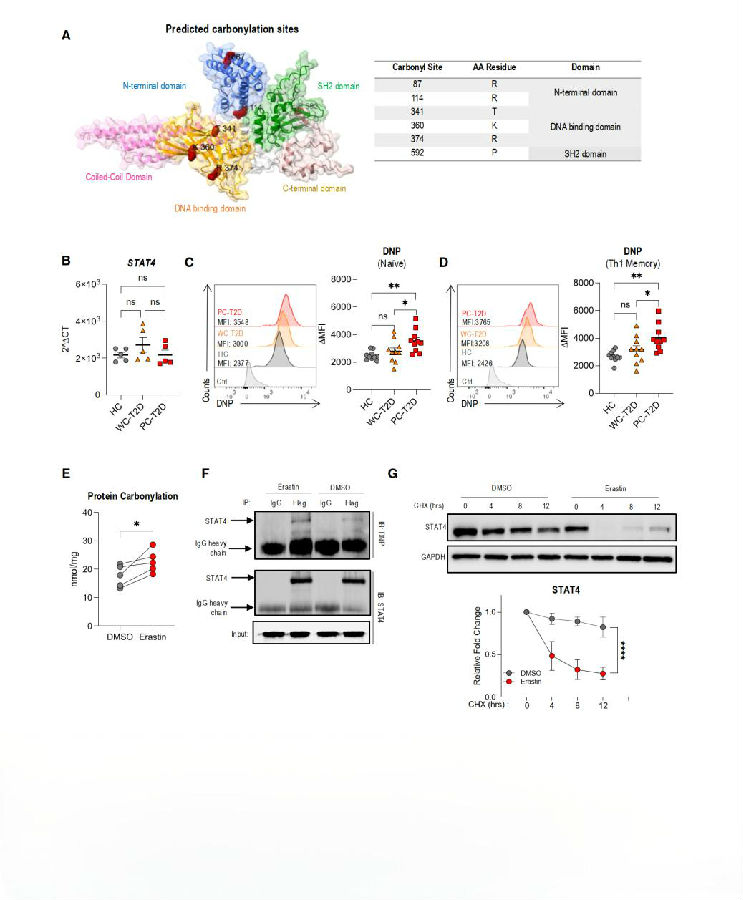
图5. LPO诱导蛋白质羰基化促进STAT4降解
(图片来自《Cell Metabolism》)
本研究结果显表明,高血糖-LPO-STAT4轴使得T2D宿主中Th1活性降低,研究揭示了Th1分化前所未有的代谢检查点,并建⽴了T2D患者病毒感染不良预后的新机制。
云克隆开发了上述研究中相关指标的蛋白、抗体和试剂盒产品,同时提供相关动物模型以助力科学研究,部分指标如下,供您参考:
相关蛋白、抗体和试剂盒:

相关动物模型: