肺部疾病的自噬机制:探索细胞自我保护与疾病治疗的新视角
肺部疾病的发病机制通常很复杂,以多种细胞事件为特征,包括炎症、细胞死亡和细胞增殖。这些事件在肺部疾病中受到调节的机制仍然知之甚少。自噬是清除细胞中“垃圾”的关键,防止异常细胞死亡,维持正常的细胞功能。它是一个依靠溶酶体降解自身细胞器或蛋白质的细胞自我保护和自我更新机制,是真核细胞中细胞稳态和应激适应的重要过程。自噬的关键作用已在广泛的病理生理条件下得到证实。在肺细胞中,自噬可能代表对暴露于应激因子(包括缺氧、氧化剂、炎症、缺血再灌注、内质网应激、药物或吸入外源性物质)引起的损伤的一般诱导适应性反应。研究发现自噬参与慢性阻塞性肺疾病(COPD)、特发性肺纤维化(IPF)、肺动脉高压(PH)、急性肺损伤、肺癌和其他肺疾病。近年来多项研究已经取得了进展,提高对自噬在实验和人类肺部疾病中的功能作用的理解方面,强调自噬在肺部疾病发病机制及其治疗靶点中的重要性。
1. PAK1介导的细胞骨架重排促进SARS-CoV-2进入和ACE2自噬降解
SARS-CoV-2是2019年新冠肺炎的病原体,对全球医疗系统和经济产生了重大影响。ACE2是一种含血管紧张素的酶,可以防止肾素-血管紧张素系统的过度激活,是SARS-CoV-2的受体。ACE2与刺突蛋白相互作用,促进病毒附着和进入宿主细胞。然而,SARS-CoV-2感染也会促进ACE2的降解。恢复ACE2表面表达是否对SARS-CoV-2感染有影响尚未确定。广州医科大学呼吸系统疾病国家重点实验室Yuxia Zhang团队表明ACE2刺突复合物通过自噬被内吞和降解,其方式取决于网格蛋白介导的内吞作用和PAK1介导的细胞骨架重排(图1)[1]。相比之下,游离细胞刺突蛋白以溶酶体依赖的方式选择性切割成S1和S2亚基。重要的是,他们发现泛PAK抑制剂FRAX-486可以恢复ACE2表面表达,并抑制不同SARS-CoV-2菌株的感染。与未经治疗的仓鼠相比,FRAX-486治疗的仓鼠的肺部病毒载量显著降低,肺部炎症减轻。这些研究结果确定了调节病毒进入的新途径,以及控制SARS-CoV-2感染毒株的治疗靶点和候选化合物。
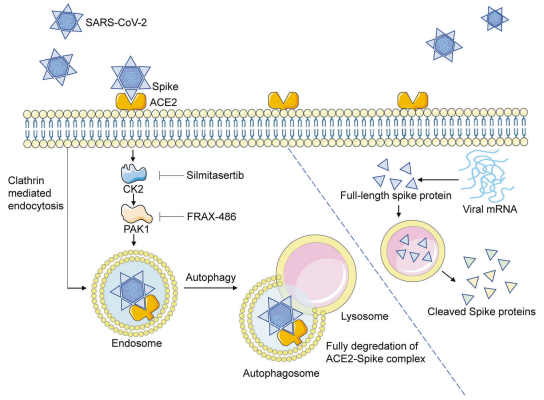
图1 ACE2刺突复合物通过网格蛋白介导的内吞作用和PAK1介导的细胞骨架重排降解
2. 超分子纳米纤维通过恢复自噬改善博莱霉素诱导的肺纤维化
IPF是一种渐进性、最终致命的间质性肺病,可用的治疗选择有限。异常TRB3/p62蛋白相互作用(PPI)导致的自噬受损有助于IPF的进展。南开大学生命科学学院药物化学生物学国家重点实验室Jie Gao团队开发了特异性结合TRB3蛋白的肽纳米纤维,并探索了其作为IPF治疗方法的潜力[2]。通过与自组装片段(Ac-GFY)结合,TRB3结合肽基序A2可形成具有稳定α-螺旋二级结构的纳米纤维。由此产生的肽(Ac-GFFY-A2)纳米纤维在盐水缓冲液中与TRB3蛋白具有特异性高亲和力结合,并且具有更好的细胞摄取A2肽的能力。此外,靶向TRB3的肽纳米纤维有效地干扰了活化的成纤维细胞和小鼠纤维化肺组织中异常的TRB3/p62 PPI,从而恢复了自噬功能障碍(图2)。TRB3靶向肽纳米纤维在体外抑制肌成纤维细胞分化、胶原蛋白产生和成纤维细胞迁移,在体内抑制博莱霉素诱导的肺纤维化。这项研究提供了一种超分子方法来调节PPI,并强调了通过恢复自噬治疗IPF疾病的有前景的策略。
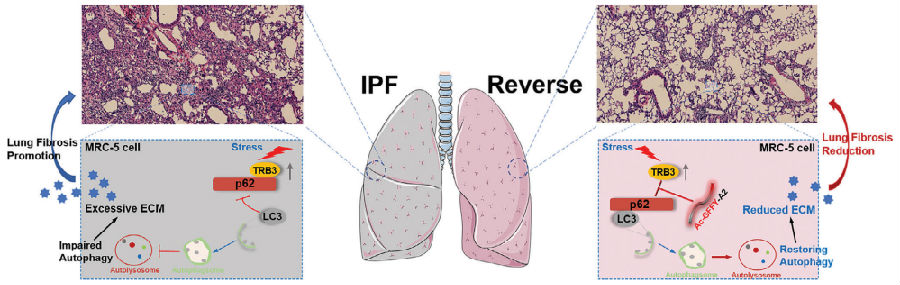
图2 自噬相关肺纤维化进展或Ac-GFFY-A2肽纳米纤维体内抗肺纤维化的可能机制
3. SMYD2甲基化PPARγ通过激活自噬促进缺氧诱导的PH
肺动脉平滑肌细胞(PASMC)的过度增殖和随之而来的肺血管重塑是PH的关键病理特征。武汉大学人民医院心内科Xin Yi团队证明赖氨酸甲基转移酶SMYD2在PH患者以及慢性缺氧诱导的PH动物模型的PASMC中的表达上调[3]。LLY-507对SMYD2的靶向抑制显著减轻了大鼠体内缺氧诱导的肺血管重塑和PH发展,并减少了体外大鼠PASMC的过度增殖。SMYD2过表达通过影响S期和G2期之间的细胞周期检查点促进大鼠PASMC的增殖,而SMYD2敲低则抑制其增殖。在机制上,SMYD2直接与PPARγ相互作用并单甲基化,抑制PPARγ的核易位和转录活性,从而进一步促进线粒体自噬,促进PASMC增殖和PH发展(图3)。PPARγ激动剂罗格列酮在很大程度上消除了SMYD2过表达对PASMC增殖和PH的不利影响。这项研究提出SMYD2-PPARγ轴通过调控线粒体自噬诱导PASMC增殖参与PH形成的表观遗传学机制,靶向抑制SMYD2或激活PPARγ可能成为防治PH的新靶点。
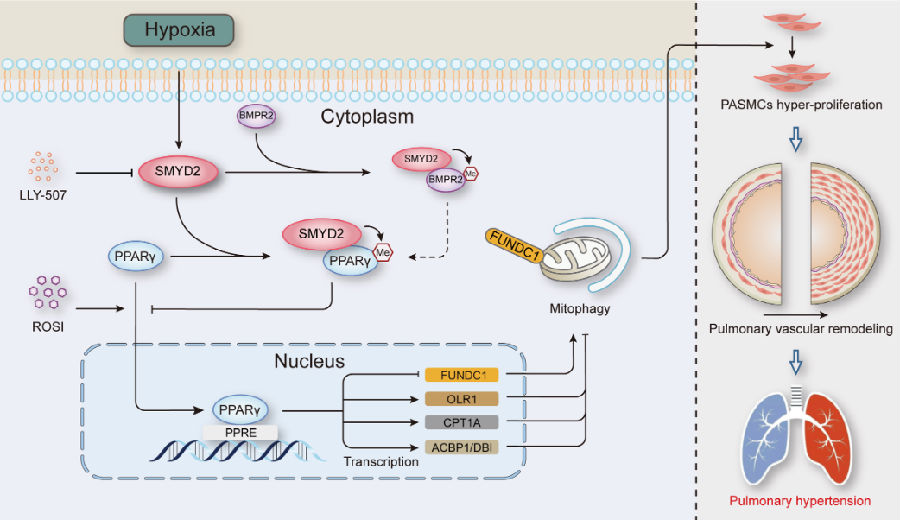
图3 SMYD2甲基化PPARγ通过激活自噬促进缺氧诱导的PH
云克隆不仅可提供多种呼吸系统疾病动物模型,包括急性肺损伤、慢性阻塞性肺疾病、哮喘、支气管炎、肺栓塞、肺炎、肺纤维化等,涵盖常见呼吸系统疾病。还具有多个物种肺微血管内皮细胞、肺成纤维细胞、肺泡上皮细胞、肺动脉平滑肌细胞等原代细胞和各类呼吸系统疾病和自噬相关检测指标,可助力广大科研工作者进行呼吸系统疾病与自噬相关研究。
相关动物疾病模型
肺纤维化(PF)小鼠模型
模型编号:DSI518Mu01
建模方法:
SPF级C57/BL6雌性小鼠,体重约18~20g。使用气管滴注博来霉素法建模。
麻醉小鼠,仰卧固定于实验台上,颈部去毛后酒精消毒,切开皮肤,逐层暴露气管,将1mL注射器经两气管软骨环间隙朝向心端刺入气管,回抽无阻力,则注入博莱霉素 5mg/kg/L(对照组注入等量的生理盐水)。手术完毕后迅速将动物直立、旋转,使药液在肺内分布均匀,动物清醒后常规饲养。
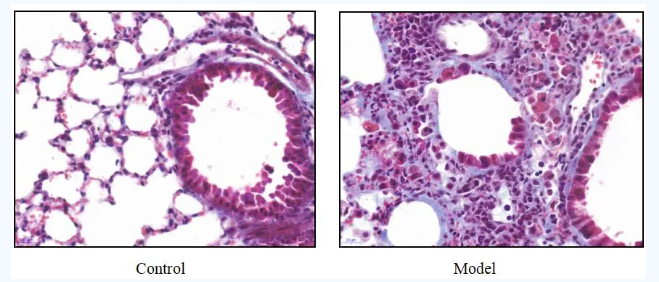
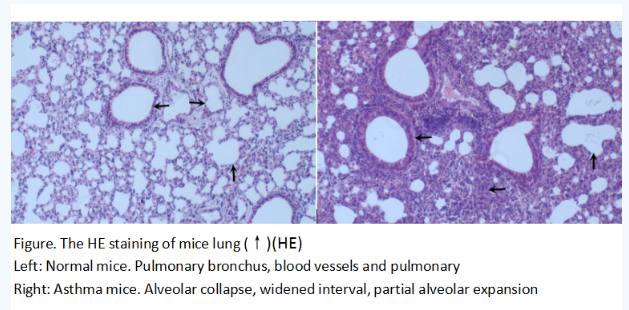
哮喘小鼠模型
模型编号:DSI528Mu01
建模方法:
1.明矾致敏佐剂:10%明矾溶液(溶于双蒸水)2ml与500ug/ml OVA(溶于PBS)2ml等量混合后,用NAOH调PH值为6.5,室温孵育60min,750r/min,离心5min,去掉上清液,重溶于2ml PBS。致敏时每只小鼠腹腔注射200ul,其中含2mg明矾和100ug OVA。
2.致敏:小鼠分别于第0、14天时腹腔注射明矾致敏佐剂0.2ml,对照组注射相同剂量的PBS溶液,正常饮食饲养。
3.激发:雾化吸入,第21天时小鼠放入有机玻璃箱,5% OVA雾化吸入。每天30min,共7d,最后一次致敏后24h内检测。以小鼠出现烦躁不安、呼吸急促、腹肌痉挛等阳性反应作为造模成功的标准。对照组采用PBS雾化吸入,其他操作均相同。
4.末次激发24h麻醉小鼠,摘眼球取血,室温静置2h后于4℃3000r离心10分钟提取血清,放入-80冰箱冻存。取左肺组织于4%多聚甲醛溶液中固定用于病理染色;右肺组织液氮冷冻,-80℃保存用于分生标本。
参考文献
[1]Liu M, Lu B, Li Y, et al. P21-activated kinase 1 (PAK1)-mediated cytoskeleton rearrangement promotes SARS-CoV-2 entry and ACE2 autophagic degradation. Signal Transduct Target Ther. 2023;8(1):385. (IF=40.8)
[2]Zheng D, Guo J, Liang Z, et al. Supramolecular Nanofibers Ameliorate Bleomycin-Induced Pulmonary Fibrosis by Restoring Autophagy. Adv Sci (Weinh). 2024;11(28):e2401327. (IF=14.3)
[3]Li Y, Wei X, Xiao R, et al. SMYD2-Methylated PPARγ Facilitates Hypoxia-Induced Pulmonary Hypertension by Activating Mitophagy. Circ Res. 2024;135(1):93-109. (IF=16.5)