抑制食物摄入,BNC2神经元能帮忙
肥胖与过度的脂肪堆积离不开关系。但在健康状态下脂肪组织原本是帮助个体抑制食欲的主力。一种来源于脂肪组织的激素——瘦素,通过调节控制食欲和代谢的特定神经群的活动来维持对脂肪组织质量的稳态控制。许多肥胖个体几乎对瘦素失去了敏感性,因此无法响应脂肪组织发出的信号。而充分了解瘦素相关的神经机制,将有望在未来带来更多的肥胖治疗靶点。
瘦素通过作用于大脑中表达瘦素受体(leptin receptor,LepR)的神经元来调节体内平衡。LepR神经元主要集中于下丘脑弓状核(Arcuate nucleus of the hypothalamus,ARC),其中最著名的两类是AGRP(Agouti Related Protein)神经元和POMC(Pro-opiomelanocortin)神经元。瘦素通过抑制促进食欲的AGRP神经元和激活厌食性POMC神经元来调节食物摄入(见图1)。然而,很多研究表明POMC神经元在瘦素信号调节中的作用有限。所以,很有可能存在一种迄今为止尚未发现的由瘦素调节的神经群,能迅速抑制食欲。

图1. 瘦素对AGRP神经元和POMC神经元的调节
(图片来源于文章“Developmental programming of hypothalamic neuronal circuits: impact on energy balance control”)
2024年10月30日,洛克菲勒大学的研究团队在《Nature》期刊上发表了题为“Leptin-activated hypothalamic BNC2 neurons acutely suppress food intake”的文章,该研究发现了一种新的瘦素靶向神经元群,这些神经元在弓状核中表达Bnc2(basonuclin 2),通过直接抑制AGRP神经元来急性抑制食欲。BNC2神经元的活性受瘦素、营养状况等的调节。在BNC2神经元中敲除LepR会导致明显的食欲亢进和肥胖,类似于AGRP神经元中敲除LepR所观察到的情况。

研究者首先获取了ARC,该区域是富集AGPR神经元和POMC神经元的区域,通过snRNA测序(Single-nucleus RNA sequencing)、流式细胞术等筛选表达Lepr的细胞,这些细胞中就有一些表达了Agrp或Pomc。研究者发现有一小簇细胞高表达Bnc2。尽管BNC2细胞群的数量少于AGRP和POMC细胞群,但BNC2细胞群的LepR表达水平显著高于POMC细胞群,与AGRP细胞群相当。后通过成年小鼠下丘脑的多重原位杂交(ISH)证实了Lepr和Bnc2的共表达。而人下丘脑中,82.1%的Lepr/Bnc2神经元不与Agrp或Pomc共定位。(见图2)

图2. 鉴定ARC中新的表达LepR的神经元
(图片来源于《Nature》杂志)
为了进一步研究ARC中BNC2神经元的动态和功能,研究者在BNC2蛋白的C端插入P2a-iCre融合片段,生成了BNC2- P2a-iCre敲入小鼠细胞系(简称BNC2-Cre)。通过在成年BNC2-Cre小鼠的ARC中注射带有Cre依赖性mCherry的腺相关病毒(adeno-associated virus,AAV),验证了在ARC中BNC2神经元中Cre的异位表达。通过瘦素处理后pSTAT3的免疫染色证实了BNC2神经元中的瘦素信号传导。瘦素与LepR结合激活JAK2(Janus酪氨酸激酶2),导致STAT3磷酸化,这是瘦素激活的典型标志物。禁食一夜后重新喂食小鼠也导致了BNC2神经元中pSTAT3含量显著增加。在禁食状态下,BNC2神经元的活性较低,而在进食诱导或瘦素刺激下活性显著增强。结果表明BNC2神经元对瘦素及进食信号高度敏感。(见图3)
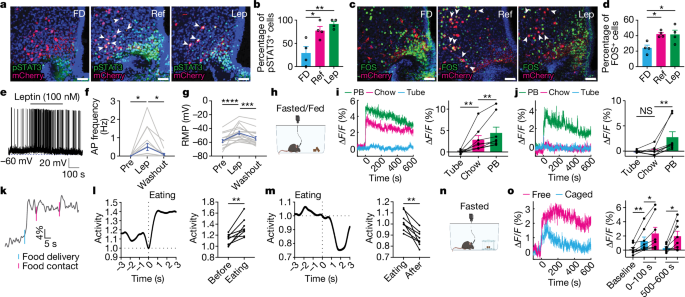
图3. 通过喂食激活BNC2神经元
(图片来源于《Nature》杂志)
接下来,研究者利用化学遗传学和光遗传学评估了BNC2神经元的功能。将表达cre依赖性刺激型hM3Dq 或抑制性hM4Di DREADD的AAVs注射到BNC2-Cre小鼠的ARC中。用CNO(clozapine-N-oxide,毒蕈碱DREADDs的激活剂)选择性地激活或抑制这些神经元。与对照组小鼠相比,在黑暗周期开始时激活BNC2神经元导致食物摄入量和体重显著减少。相比之下,在光照周期内抑制BNC2神经元显著增加了雄性和雌性小鼠的食物消耗和体重。激活BNC2神经元20分钟,导致禁食过夜的小鼠的食物摄入量显著减少,并且在停止光刺激后,食物摄入量减少持续了20分钟。(见图4)
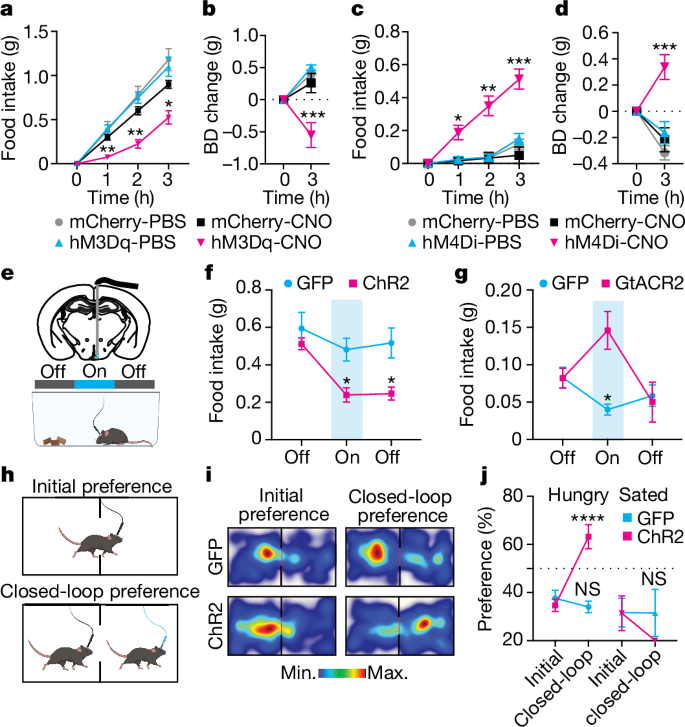
图4. 由BNC2神经元驱动的快速和持续的饱腹感
(图片来源于《Nature》杂志)
研究者还发现激活BNC2神经元会抑制AGRP/NPY(Neuropeptide Y,神经肽Y)神经元活性,如此进一步让食欲大减。AGRP是由AGRP/NPY神经元在大脑中产生的神经肽。它仅在位于ARC的含有NPY的细胞体中合成,AGRP与NPY共表达。该研究表明BNC2神经元是通过GABAA受体直接抑制的AGRP/NPY神经元,而AGRP/NPY神经元激活不改变BNC2神经元的活性。禁食过夜再摄食后抑制AGRP/NPY神经元的部分感觉输入是由BNC2神经元传递的。(见图5)
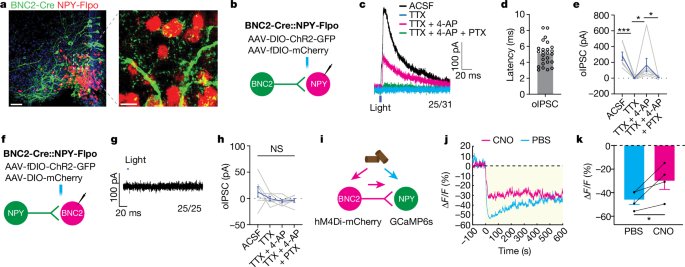
图5. BNC2神经元抑制AGRP/NPY神经元
(图片来源于《Nature》杂志)
接着,研究者通过CRISPR-Cas9基因组编辑技术敲除了BNC2神经元中的LepR,发现瘦素不再增加pSTAT3的量,从而证实了Lepr基因的特异性缺失。与此同时,跟对照组相比,BNC2神经元中LepR敲除的雄性和雌性小鼠体重、脂肪质量、每日食物摄入量都显著增加。研究者进一步评估了BNC2神经元在介导瘦素信号传导中的作用,发现尽管注射瘦素显著减少了两组小鼠的食物摄入量,但敲除组小鼠比对照组小鼠消耗的食物明显更多。消融ARC中的BNC2神经元后发现瘦素的作用显著降低。这些数据表明,BNC2神经元中的LepR是瘦素充分发挥作用所必需的。接着研究者分析了LepR敲除后的葡萄糖稳态,发现敲除组雄性小鼠空腹血糖水平升高,小鼠对胰岛素的反应显著降低。激活BNC2神经元后,小鼠的葡萄糖耐量和胰岛素敏感性有所改善。这些数据表明,BNC2神经元可以急性调节外周葡萄糖稳态。(见图6)
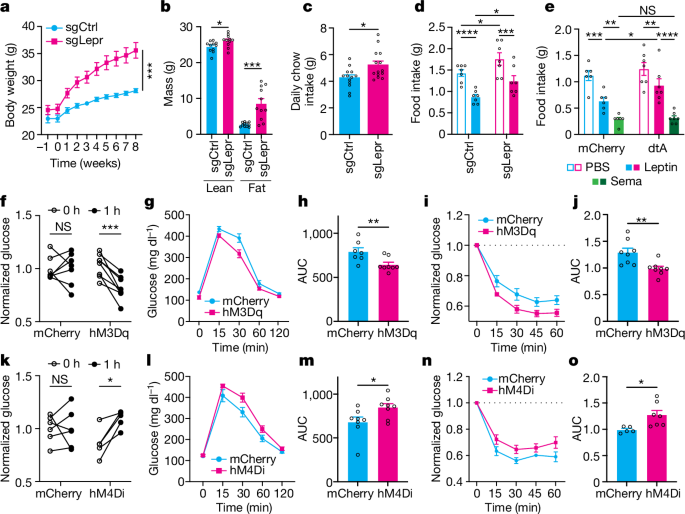
图6. 在BNC2神经元中敲除LepR会导致肥胖
(图片来源于《Nature》杂志)
综上,表达BNC2的神经元是维持能量平衡的神经回路的关键组成部分,该研究填补了对食物摄入和瘦素作用调控的神经机制的一大空白,为调节食欲、帮助减肥、研究代谢相关疾病带来了新的靶点和新的策略,具有广泛的临床应用前景。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/