一种独特的细胞死亡形式——氨死亡
2024年9月华中科技大学基础医学院黄波教授团队在《Nature Cell Biology》期刊发表了题为“Ammonia-induced lysosomal and mitochondrial damage causes cell death of effector CD8+ T cells”的研究论文。发现了氨诱导效应T细胞的一种独特形式的细胞死亡。研究发现,快速增殖的T细胞利用谷氨酰胺分解在线粒体中释放的氨,然后氨转移到溶酶体并储存在溶酶体中。过量的氨积累增加溶酶体pH值,导致溶酶体氨储存终止和氨回流进入线粒体,导致线粒体损伤和细胞死亡,这一细胞死亡方式与之前发现的其他形式细胞死亡机制不同。

1. 氨诱导CD8+效应T细胞死亡
为了探讨氨在效应CD8+ T细胞死亡中发挥的作用,研究团队将靶向卵清蛋白(OVA)的CD8+ T细胞(OT-I)过继转移给小鼠体内,随后感染表达卵清蛋白的单核增生李斯特菌(Lm-OVA)。实验发现,氨水平先降低,后逐渐升高,且在输注后第12天达到高峰,此时,OT-I细胞也大量死亡,推测增加氨浓度可能会导致效应T细胞死亡。通过添加外源性NH4Cl可以诱导效应T细胞死亡,同时发现氨甲酰磷酸合成酶1(CPS1)在各个时间点的效应CD8+ T细胞中表达均缺乏,CPS1是CD8+ T细胞中触发尿素循环并解毒氨中毒的关键酶。在体内外过表达CPS1均可以显著降低了效应CD8+ T细胞的死亡同时降低氨水平。4-苯丁酸(4PBA)是一种通过乙酰化与谷氨酰胺结合形成苯乙酰谷氨酰胺来清除氨的药物,通过体内注射4PBA发现效应CD8+ T细胞比例增加同时氨浓度降低。从形态学上,观察到死亡的效应CD8+ T细胞在收缩过程中表现出大量的胞质空泡,而这在其他形式的细胞死亡中没有观察到。以上结果表明氨的积累可能在效应CD8+ T细胞中诱导一种新的细胞死亡形式。
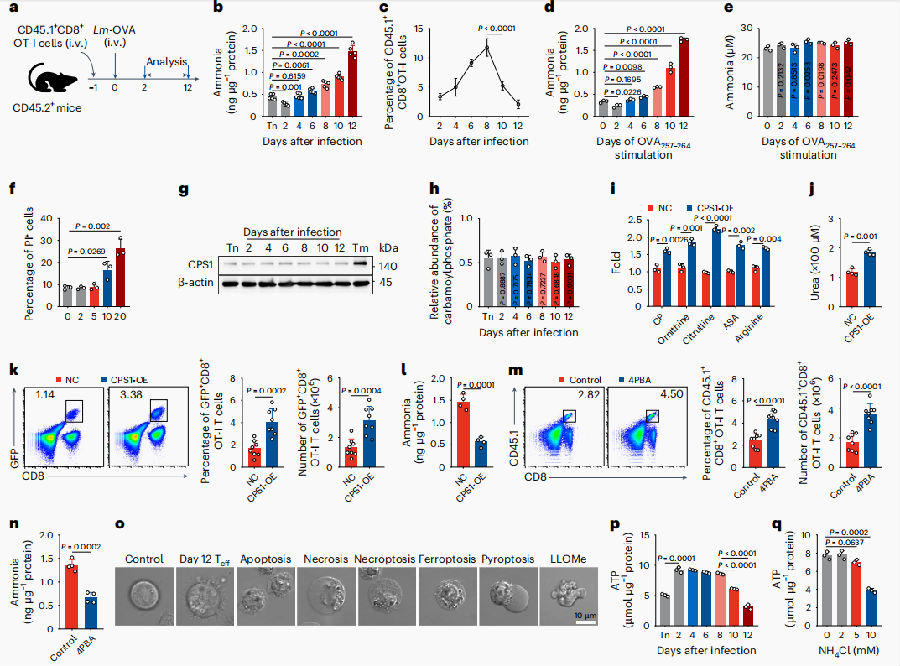
图1. 氨可能诱导了效应CD8+ T细胞中一种新的细胞死亡形式
2. 谷氨酰胺衍生的氨导致效应T细胞的死亡
氨主要由谷氨酰胺通过线粒体谷氨酰胺酶1(GLS1)催化产生。为了验证氨的来源,将OT-I细胞过继转移到小鼠体内,然后用DON或CB839抑制线粒体谷氨酰胺酶1(GLS1),发现体内氨被明显抑制同时脾脏中效应T细胞显著增加。氨示踪显示Lm-OVA感染后8天在效应CD8+ T细胞中积累的氨源于谷氨酰胺。在Lm-OVA感染后的第1天和第7天,JHU083或CB839抑制GLS1并不影响氨水平,但减少了OT-I效应T细胞的增殖。然而,在第7天和第14天,通过诱导GLS1敲除,可增加效应T细胞数量并降低氨水平。与此相一致,研究团队观察到,在Lm-OVA感染后第8天,谷氨酰胺开始在效应CD8+ T细胞中积累。

图2. 谷氨酰胺衍生的氨导致效应T细胞的死亡
3. 氨损伤效应CD8+ T细胞溶酶体
接下来探讨氨诱导效应CD8+ T细胞死亡的机制。研究发现,上述效应T细胞的溶酶体中的氨的水平逐渐升高,并在细胞死亡时达到最高水平,氨示踪证实溶酶体内氨来源于线粒体。随着氮水平的增加,溶酶体pH值也会增加,pH值的改变可能会损伤溶酶体。随后观察到,氨水平的增加确实显著降低了胱天蛋白酶B、胱天蛋白酶D、β-半乳糖苷酶和α-甘露糖苷酶的活性且溶酶体膜通透性(LMP)显著升高。而当GLS1抑制剂作用时,则可以抑制上述结果的出现。这些结果表明,氨从线粒体输出并储存在溶酶体中并损伤溶酶体。那么,氨是怎么进入溶酶体的呢?最近的研究表明RH家族糖蛋白(RHAG,RHBG和RHCG)可以作为氨转运体,研究团队发现,效应CD8+ T细胞高表达RHCG,RHCG的增加出现在晚期激活的效应CD8+ T细胞的膜旁细胞器中,特别是在溶酶体中。溶酶体中的氨含量上升,线粒体中的氨含量下降,细胞总氨含量不变,这种RHCG过表达可以加速效应CD8+ T细胞的死亡,给予GLS1抑制剂可以抑制上述结果的出现。这说明线粒体排出的氨通过RHCG转运到溶酶体中。因此,溶酶体pH值的增加在氨死亡中起着关键作用,并可能是这种细胞死亡的一个指标。
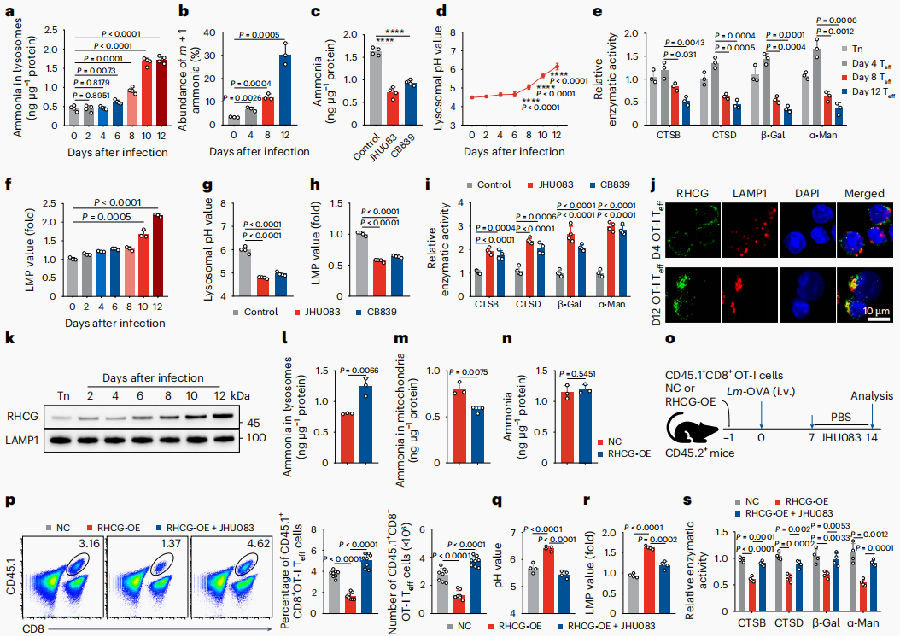
图3. 氨损伤效应CD8+ T细胞溶酶体
4. 氨滞留导致线粒体损伤
以上结果表明,氨从线粒体转移到细胞质中,然后进入溶酶体。然而,高浓度的溶酶体氨可能会阻止溶酶体吸收胞质氨,导致线粒体氨滞留。与此一致,研究团队发现在刺激8天的T细胞中观察到线粒体氨水平升高且线粒体膜电位降低,这种高浓度的氨可能会导致线粒体损伤。进一步观察到晚期和早期效应T细胞中线粒体数量并没有变化,但晚期效应T细胞中线粒体DNA(mtDNA)拷贝数明显降低,并观察到线粒体形态损伤,包括细胞膜和嵴结构破坏,嵴数量减少。为了证实观察到的线粒体损伤与氨滞留有关,研究团队在体内过表达CPS1以降低氨水平,或使用GLS1抑制剂来抑制过继转移的OT-I细胞中氨的形成。在这两种情况下,受损的线粒体可以被逆转。
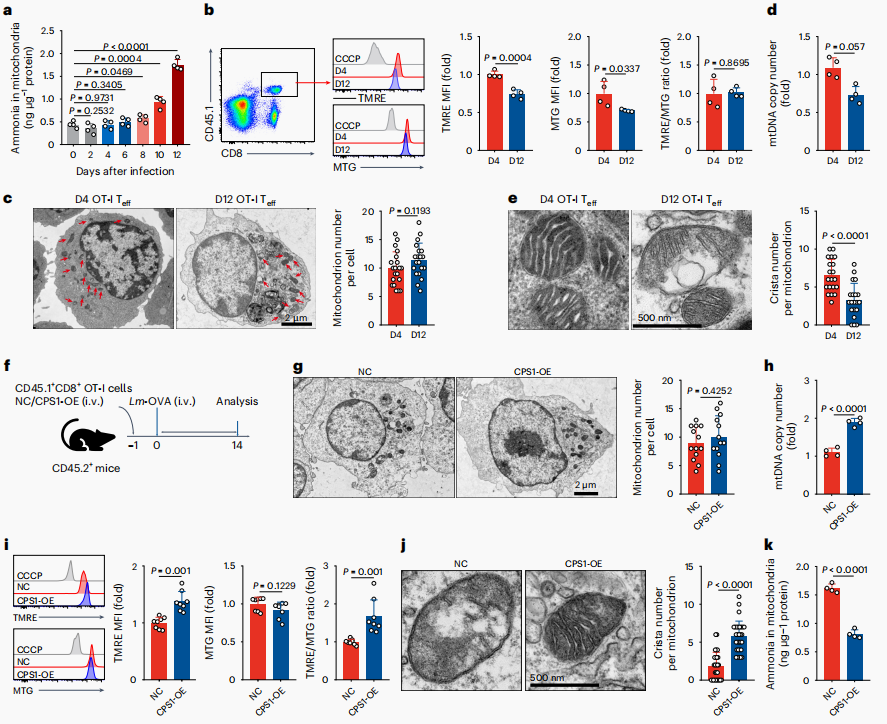
图4. 氨滞留导致线粒体损伤
5. 损伤的线粒体不能通过自噬被清除
受损的线粒体被一种称为线粒体自噬的选择性自噬过程所消除,然而,在晚期激活的效应CD8+ T细胞中观察不到线粒体吞噬体样结构,且参与线粒体自噬的两个关键蛋白PINK1和Parkin的表达水平没有改变。LC3与线粒体共定位可作为线粒体吞噬的标记物,同样,在第4天和第12天的效应T细胞中几乎没有观察到这种共定位。这些结果表明,线粒体自噬并不能有效地清除晚期激活的效应T细胞中受损的线粒体。除了线粒体自噬,巨自噬在晚期激活的效应CD8+ T细胞中似乎受损,尽管形成了自噬小体,但p62效应CD8+ T细胞的积累提示自噬流被中断。然而,用C381(一种靶向空泡型ATP酶的小分子来降低溶酶体pH)可以恢复损伤的自噬流,且C381处理降低了活化的OT-I效应T细胞死亡。

图5. 损伤的线粒体不能通过自噬被清除
6. 氨死亡阻断增强了对癌症的过继T细胞治疗
最后,将OT-I 效应T细胞过继地转移到B16-OVA黑色素瘤荷瘤小鼠中,在第4-10天解剖肿瘤浸润的OT-I细胞,发现氨积累且溶酶体pH增加。为了确定氨的积累是否影响OT-I效应T细胞的持久性,使用C381或JHU083对B16-OVA荷瘤小鼠进行预处理3天,并在OT-I效应T细胞转移后继续进行这种处理,14天后发现可抑制肿瘤生长,延长小鼠存活时间。通过诱导性的GLS1的敲除和过表达CPS1的OT-I T细胞的过继转移,均得到了类似的结果。这些结果表明,氨阻断通过改善T细胞的持久性来增强过继T细胞治疗癌症。
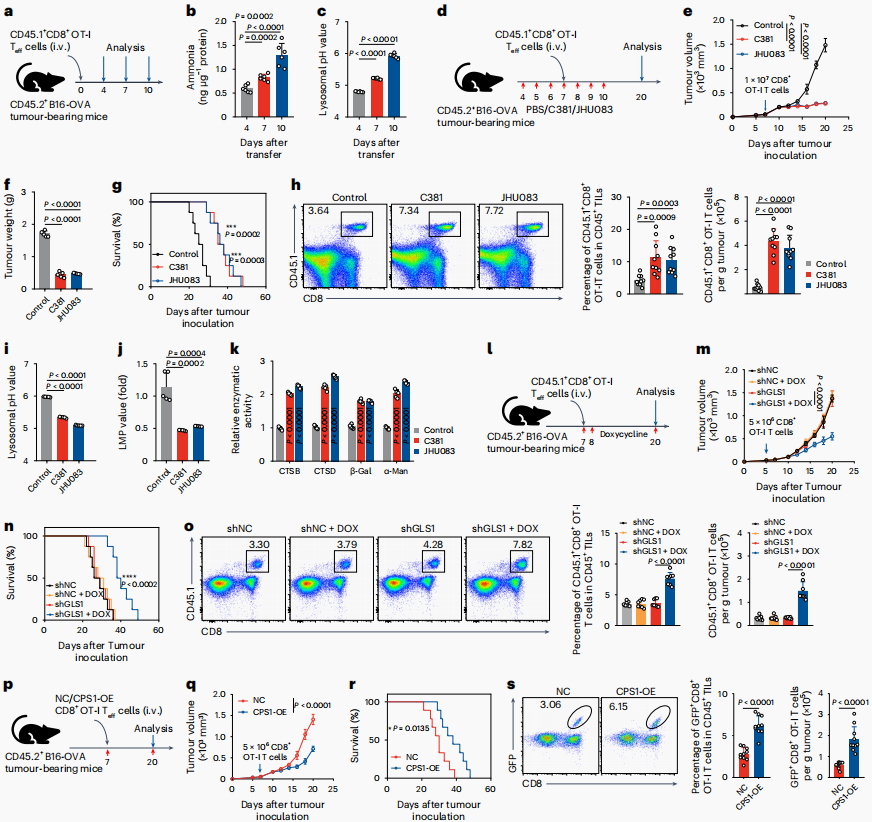
图6. 氨阻断通过改善T细胞的持久性来增强过继T细胞治疗癌症
云克隆开发了与该研究相关的靶标产品,部分靶标节选如下:
靶标 | 核心货号 | 靶标 | 核心货号 |
CD45 | B030 | CD8a | B099 |
Ki67 | C047 | CPS1 | J352 |
P62 | C257 | BNIP3 | J545 |
LAMP1 | B441 | Calnexin | A280 |
Atg5 | L221 | Atg12 | L224 |
Syntaxin 6 | C878 | PARK2 | L060 |
PINK1 | L057 |